Chymotrypsin
Chymotrypsinu je peptidázy zažívací vylučovaný slinivky břišní , z rodiny serinových proteáz , který katalyzuje na proteolýzu . Je kódován dvěma geny umístěnými na chromozomu 16 , jejichž produktem je proenzym nazývaný chymotrypsinogen , který musí být později aktivován, aby poskytl samotný chymotrypsin. Tento enzym s výhodou hydrolyzuje na proteiny na úrovni peptidových vazeb po proudu od zbytku z tyrosinu , z tryptofanu , z fenylalaninu , z methioninu nebo leucin . Aktivní místo chymotrypsinu má hydrofobní kapsu , ve kterém aminokyselina na substrátu je uložena . To umožňuje štěpení polohy vazby naproti katalytickému serinu.
Chymotrypsin| Č. ES | ES |
|---|---|
| Číslo CAS |
| IUBMB | Vstup IUBMB |
|---|---|
| IntEnz | IntEnz pohled |
| BRENDA | Vstup BRENDA |
| KEGG | Vstup KEGG |
| MetaCyc | Metabolická cesta |
| PRIAM | Profil |
| PDB | Struktury |
| JÍT | AmiGO / EGO |
Syntéza a aktivace
Chymotrypsin je produkován slinivkou břišní v neaktivní formě zvané chymotrypsinogen . Aktivace je způsobena trypsinem, který rozřezá tuto molekulu na dva řetězce, poté samotným chymotrypsinem během trans- proteolýzy, což na konci poskytne kompaktní globulární strukturu tří řetězců spojených dvěma disulfidovými můstky a složených ve 2 doménách se 120 aminokyselinami.
Tyto domény přijímají konformaci β barelu vytvořeného ze 6 β řetězců.
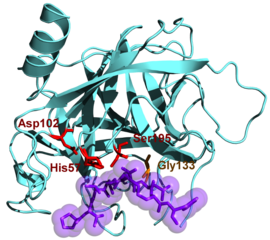
Aktivní web se nachází v trhlině ohraničené 2 oblastmi. Váže se na substrát na úrovni 2 regionů (oblast 214-216, nespecifická vazba a oblast 189-216 a 226, specifická vazba).
Mechanismus akce
Chymotrypsin se podílí na proteolýze z proteinů v trávicím systému ze savců a jiných živých bytostí. Katalyzuje štěpení polypeptidových řetězců hydrolýzou , což je mechanismus zpočátku extrémně pomalý bez aktivátoru.
Chymotrypsin napadá potenciálně nukleofilní karbonylové skupiny zapojené do peptidové vazby prostřednictvím serinu 195, který se váže na svůj substrát za vzniku kovalentního meziproduktu substrát-enzym. Aktivní místo enzymu také zahrnuje aminokyseliny His57, Asp102 a Gly193.
Ukázalo se, že reakce chymotrypsinu s jeho substrátem probíhá ve dvou fázích: počáteční nárazová fáze na samém začátku reakce, poté fáze ustáleného stavu, která se řídí zákonem Michaelis-Menten .
Chymotrypsin musí být absolutně udržován v chladu, aby se udržela enzymatická aktivita.
-
Mechanismus účinku chymotrypsinu.
Sekvence
Sekvence chymotrypsinogenu B1 (geny 16q23 a 16q24.1)
10 20 30 40 50 60 MASLWLLSCF SLVGAAFGCG VPAIHPVLSG LSRIVNGEDA VPGSWPWQVS LQDKTGFHFC 70 80 90 100 110 120 GGSLISEDWV VTAAHCGVRT SDVVVAGEFD QGSDEENIQV LKIAKVFKNP KFSILTVNND 130 140 150 160 170 180 ITLLKLATPA RFSQTVSAVC LPSADDDFPA GTLCATTGWG KTKYNANKTP DKLQQAALPL 190 200 210 220 230 240 LSNAECKKSW GRRITDVMIC AGASGVSSCM GDSGGPLVCQ KDGAWTLVGI VSWGSDTCST 250 260 SSPGVYARVT KLIPWVQKIL AANSekvence chymotrypsinogenu B2 (gen 16q23.1)
10 20 30 40 50 60 MAFLWLLSCW ALLGTTFGCG VPAIHPVLSG LSRIVNGEDA VPGSWPWQVS LQDKTGFHFC 70 80 90 100 110 120 GGSLISEDWV VTAAHCGVRT SDVVVAGEFD QGSDEENIQV LKIAKVFKNP KFSILTVNND 130 140 150 160 170 180 ITLLKLATPA RFSQTVSAVC LPSADDDFPA GTLCATTGWG KTKYNANKTP DKLQQAALPL 190 200 210 220 230 240 LSNAECKKSW GRRITDVMIC AGASGVSSCM GDSGGPLVCQ KDGAWTLVGI VSWGSRTCST 250 260 TTPAVYARVA KLIPWVQKIL AANPoznámky a odkazy
- jsou hodnoty hmotnosti a počtu zbytků zde uvedeno, jsou ty, které v prekurzorového proteinu vyplývající z překladu z genu , před posttranslačních modifikací , a mohou se výrazně liší od odpovídajících hodnot Pro funkční protein .