Trimethylaluminium
| Trimethylaluminium | |
| |
| Trimethylaluminium | |
| Identifikace | |
|---|---|
| Název IUPAC | Trimethylalane |
| Synonyma |
trimethylaluminium |
| N O CAS | |
| Ne o ECHA | 100 000 776 |
| Ne o EC | 200-853-0 |
| N O RTECS | BD2204000 |
| PubChem | 16682925 |
| ÚSMĚVY |
C [Al] (C) ([CH3] 1) [CH3] [Al] 1 (C) C , |
| InChI |
Std. InChI: InChI = 1S / 3CH3.Al / h3 * 1H3; Std. InChIKey: JLTRXTDYQLMHGR-UHFFFAOYSA-N |
| Vzhled | bezbarvá, samozápalná kapalina |
| Chemické vlastnosti | |
| Hrubý vzorec |
C 6 H 18 Al 2 [izomery] |
| Molární hmotnost | 144,1702 ± 0,0061 g / mol C 49,99%, H 12,58%, Al 37,43%, |
| Fyzikální vlastnosti | |
| T. fúze | 15 ° C |
| T ° vroucí | 125 až 126 ° C |
| Rozpustnost | 2790 mg · l -1 |
| Objemová hmotnost | 0,752 g · cm -3 ( 25 ° C ) |
| Bod vzplanutí | −17 ° C (uzavřený kelímek) |
| Tlak nasycených par | 92,4 hPa ( 60 ° C ) |
| Opatření | |
| SGH | |
  H250, H260, H314, P222, P223, P280, P231 + P232, P370 + P378, P422,
H250 : Při kontaktu se vzduchem se spontánně vznítí
H250, H260, H314, P222, P223, P280, P231 + P232, P370 + P378, P422,
H250 : Při kontaktu se vzduchem se spontánně vznítí H260 : Při styku s vodou uvolňuje hořlavé plyny, které se mohou samovznítit H314 : Způsobuje těžké poleptání kůže a poškození očí P222 : Zamezte styku se vzduchem. P223 : Zamezte kontaktu s vodou kvůli riziku prudké reakce a samovznícení. P280 : Noste ochranné rukavice / ochranný oděv / ochranné brýle / obličejový štít. P231 + P232 : Zacházejte pod inertním plynem. Chraňte před vlhkostí. P370 + P378 : V případě požáru: K hašení použijte…. P422 : Ukládat obsah pod ... |
|
| WHMIS | |
 B6, |
|
| NFPA 704 | |
| 3 3 3 | |
| Ekotoxikologie | |
| LogP | 1970 |
| Jednotky SI a STP, pokud není uvedeno jinak. | |
Trimethylaluminia (nebo trimethylhliník ) je chemická sloučenina vzorce Al 2 ( CH 3 ) 6 , zkráceně Al 2 Me 6 (ALME 3 ) 2 , nebo TMA.
Jedná se o molekulu rodiny organoaluminia , samozápalnou (která hoří při kontaktu se vzduchem) a která se při pokojové teplotě prezentuje jako téměř bezbarvá kapalina produkující bílý kouř (částice oxidu hlinitého).
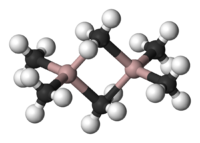
Chemická struktura
Al 2 Me 6 existuje jako dimer , analogický (svou strukturou a vazbami) jako diboran . Stejně jako v případě diboranu, molekuly jsou spojeny dvěma vazbami se třemi centry a dva elektrony přes na methylenový můstek sdílené mezi dvěma skupinami atomů hliníku. Atomy uhlíku methylových skupin jsou obklopeny pěti sousedními atomy : třemi atomy vodíku a dvěma atomy hliníku . Methylové skupiny si snadno vyměňují svou pozici ve stejné molekule a mezi různými molekulami.
Syntéza a aplikace
TMA se připravuje dvoustupňovým procesem, který lze shrnout takto:
2 Al + 6 CH 3 Cl + 6 Na → Al 2 (CH 3 ) 6 + 6 NaCl.TMA se používá zejména pro výrobu methylaluminoxanu (Al (CH 3 ) O) n ), aktivátor reakcí Ziegler-Natta z heterogenní katalýzy pro polymeraci z olefinů . TMA se proto používá jako metylační činidlo . Tebbe reakční činidlo použit pro methylenací esterů a ketonů , a je připraven z TMA. TMA se často uvolňuje ze znějících raket a produkuje bílý kouř, který se používá jako stopovací látka při studiích větrných vzorů v horní atmosféře.
TMA je také použit ve výrobě některých tenkovrstvých polovodičů , zejména „ vysoce-k dielektriky “, jako je Al 2 O 3 pomocí chemické párové depozice nebo atomové tenkých vrstev procesů .
TMA tvoří komplex s terciárním aminem DABCO , se kterým je manipulace bezpečnější než se samotným TMA.
V kombinaci s Cp 2 ZrCl 2 ( zirkonocendichloridu ), přičemž (CH 3 ) 2 Al-CH 3 skupina vytváří carboalumination reakci .
NASA (Mission ATREX pro anomálního transportu Rocket experiment ) používá bílý kouř, který formy kontaktu se vzduchem do TMA ke studiu „ tryskové proudění “ ve vysoké nadmořské výšce.
TMA a polovodiče
TMA se stala preferovaným organokovovým zdrojem výrobců polovodičů pro organokovovou epitaxi v plynné fázi (nebo MOVPE ). Kritériem kvality TMA je pak jeho obsah elementárních nečistot a nečistot (okysličených a / nebo organických), které musí být co nejnižší.
Podívejte se také
Související články
externí odkazy
- (en) Informativní obchodní spojení s trimethylaluminiem a jinými metalorganiky .
- (en) Interaktivní graf tlaku par pro metalorganiky .
- (en) Článek mise NASA ATREX .
Poznámky a odkazy
- vypočtená molekulová hmotnost od „ atomové hmotnosti prvků 2007 “ na www.chem.qmul.ac.uk .
- Sigma-Aldrichův list sloučeniny Trimethylaluminium , konzultováno 27. srpna 2012.
- (in) „ trimethylaluminium “ na ChemIDplus , přístup k srpnu 2012 237
- Soubor CSST
- (en) Holleman, AF; Wiberg, E., Anorganic Chemistry , San Diego, Academic Press ,2001( ISBN 0-12-352651-5 )
- (en) Biswas, K.; Prieto, O .; Goldsmith, PJ; Woodward, S., „ Remarkafully Stable (Me 3 Al) 2 · DABCO and Stereoselective Nickel-Catalyzed AlR 3 (R = Me, Et) Adds to Aldehydes “ , Angewandte Chemie International Edition , sv. 44, n o 15, 2005, str. 2232–2234 ( PMID 15768433 , DOI 10.1002 / anie.200462569 )
- (en) Negishi, E.; Matsushita, H., Palladium-Catalyzed Synthesis of 1,4-Dienes by Allylation of Alkenyalane: a-Farnesene [1,3,6,10-Dodecatetraene, 3,7,11-trimethyl-] , Org. Synth. 62 , sb. „let. 7 ",1984, 31 str. , str. 245
