Chlormethan
| Chlormethan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Struktura chlormethanu |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Název IUPAC | chlormethan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyma |
Methylchlorid |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne o ECHA | 100 000 744 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne o EC | 200-817-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 6327 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 36014 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ÚSMĚVY |
CCl , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / CH3Cl / c1-2 / h1H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | bezbarvý plyn se sladkou vůní | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemické vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hrubý vzorec |
C H 3 Cl [izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární hmotnost | 50,488 ± 0,003 g / mol C 23,79%, H 5,99%, Cl 70,22%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzikální vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T. fúze | -97,6 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° vroucí | -24,2 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpustnost | 5 g · l -1 ( voda , 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
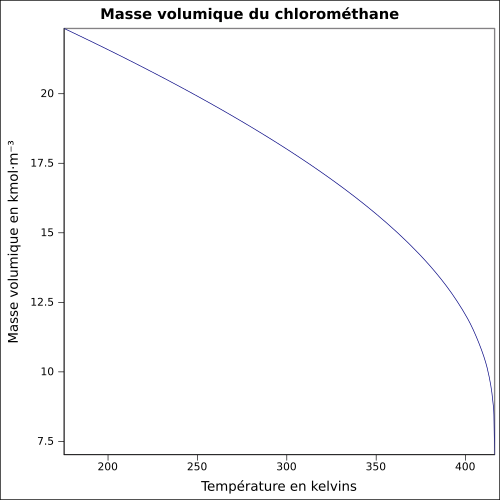
| Objemová hmotnost |
2,3065 g · l -1 ( 0 ° C , 1013 mbar )
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota samovznícení | 632 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Meze výbušnosti ve vzduchu | 7,6 - 19 % obj | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tlak nasycených par |
4,896 bar při 20 ° C 6,6 bar při 30 ° C 10,9 bar při 50 ° C rovnice:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritický bod | 143 ° C , 66,7 bar , 0,353 kg · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trojitý bod | -97,71 ° C , 0,00876 bar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 plyn, 1 bar | 234,36 J · K -1 · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 kapalina, 1 bar | 140,08 J · K -1 · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 plyn | -83,68 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 kapalina | -102,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ fus H ° | 6,431 kJ · mol -1 až 175,44 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° | 20,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C str |
81,2 J · K -1 · mol -1 až 298 K.
rovnice:
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCI | -764,0 kJ · mol -1 (plyn) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronické vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ionizační energie | 11,22 ± 0,01 eV (plyn) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opatření | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Nebezpečí H220, H351, H373, H220 : Extrémně hořlavý plyn H351 : Podezření na vyvolání rakoviny (uveďte cestu expozice, je-li přesvědčivě prokázáno, že žádná jiná cesta expozice nezpůsobuje stejné nebezpečí) H373 : Může způsobit poškození orgánů (uveďte všechny postižené orgány, jsou-li známy) po opakování expozice nebo dlouhodobá expozice (uveďte cestu expozice, je-li přesvědčivě prokázáno, že žádná jiná cesta expozice nevede ke stejnému nebezpečí) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 2 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Doprava | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
23 : hořlavý plyn UN číslo : 1063 : METHYLCHLORID; nebo REFRIGERANT GAS R 40 Třída: 2.1 Štítek: 2.1 : Hořlavé plyny (odpovídá skupinám označeným velkým F); Balení: -  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klasifikace IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina 3: Nezařaditelné z hlediska jeho karcinogenity pro člověka | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoxikologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | 1,8 g · kg -1 (potkan, orálně ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 0,91 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prahová hodnota zápachu | nízká: 10 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednotky SI a STP, pokud není uvedeno jinak. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Methylchlorid , také známý jako methylchlorid , Freon 40 nebo R40 , je chemická sloučenina podle obecného vzorce CH 3 Cl. Jedná se o chladivo, které se také používá jako činidlo pro mnoho syntéz.
Biogeneze a přítomnost v přírodě
Tyto halogenalkany ( druh vazby, obsahující uhlík - halogen ) se vyrábějí - pravděpodobně prostřednictvím různých biologických procesů, - podle některých hub, živočichů a rostlin. CH 3 Cl molekula byl tedy navržen jako možný marker života v případě, že je detekován v atmosférách skalních exoplanet.
Brakická rostlina Batis maritima produkuje enzym methylchlorid-transferázu , která katalyzuje syntézu CH 3 Cl z S-adenosin-L-methioninu a chloru. Tento protein byl purifikován, poté zaveden a exprimován genetickým inženýrstvím v bakterii E. coli . Rovněž se zdá, že je aktivní v mikroskopických houbách, jako je Phellinus pomaceus , červené řasy (např. Endocladia muricata ) nebo místní druhy rostlin, které se stávají lokálně invazivními , Mesembryanthemum crystalinum , o nichž je známo, že také produkují CH 3 Cl. Laboratorní model Arabidopsis thaliana .
Přítomnost ve vesmíru
V roce 2017 molekula CH 3 Clbyl detekován ve sluneční soustavě i mimo ni . První pomocí interferometru ALMA kolem protostar ze slunečního typu IRAS16293-2422 v oblasti, kde planety by mohl tvořit. Poté spektrometrem ROSINA (na palubě sondy Rosetta ) v kometě 67P / Tchourioumov-Guérassimenko .
Objev CH 3 Clv místech před (známým) původem života naznačuje, že k závěru o přítomnosti života na jiných planetách bude nutné použít další definitivní biomarkery. Na druhé straně by organohalogeny mohly představovat prvek porozumění chemii podílející se na vzniku života.
Fyzikálně-chemické vlastnosti
Chlormethan se hydrolyzuje pomocí vody při vysoké teplotě, aby se forma methanol CH 3 OHa chlorovodík HCl:
CH 3 Cl+ H 2 O→ CH 3 OH+ HCl .Tato reakce je katalyzována alkalickými sloučeninami. Reciproční reakce umožňuje syntetizovat CH 3 Clprobubláváním chlorovodíku v methanolu za případné přítomnosti chloridu zinečnatého ZnCl 2jako katalyzátor nebo reakcí methanolu a chlorovodíku při 350 ° C s oxidem hlinitým Al 2 O 3 :
CH 3 OH+ HCl → CH 3 Cl+ H 2 O.Při nižších teplotách vytváří methylchlorid s vodou hydrát , což je problém v chladicích systémech.
použití
Chlormethan se používá pro přípravu dimethyldichlorsilanu Si (CH 3 ) 2 Cl 2prostřednictvím syntézy Müller-Rochow :
2 CH 3 Cl+ Si → Si (CH 3 ) 2 Cl 2.Je to důležitá syntetická cesta pro výrobu silikonů .
Používá se také jako činidlo pro Wurtz-Fittigovu reakci nebo Friedel-Craftsovy reakce používané k výrobě alkylbenzenů. Je důležitým činidlem pro methylaci, zejména aminy pro tvorbu kvartérních methylaminů nebo hydroxylových skupin za vzniku etherů .
Výroba a syntéza
Tento plyn se vyrábí chlorací z metanu s chloru plynu 400 , aby 500 ° C . Chlorační mechanismus je radikální řetězová reakce prostřednictvím radikálů, které jsou výsledkem disociace chloru. Tuto disociaci lze získat tepelně, fotochemicky nebo katalyzátory. Upřednostňuje se tepelná cesta, která vede k řadě po sobě následujících náhrad:
CH 4 + Cl 2 → CH 3 Cl + HCl CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl CH 2 Cl 2 + Cl 2 → CHCI 3 + HCl CHCI 3 + Cl 2 → CCl 4 + HClVýsledkem této série reakcí je směs chlormethanu, dichlormethanu , chloroformu a tetrachlormethanu . Tyto sloučeniny se potom oddělí destilací . V reaktoru se používá přebytek metanu a recykluje se v přítomnosti inertního plynu, aby se zabránilo práci v oblasti, kde je směs methanu a chloru výbušná.
Další syntetická cesta je hydrochlorace z methanolu chlorovodíkem. Tato reakce je v současné době upřednostňována, protože spotřebovává chlorovodík, který je obtížně odstranitelný jako vedlejší produkt, místo toho, aby se vyráběl jako v případě chlorace. Kromě toho syntéza vede k produkci samotného chlormethanu a vyhýbá se produkci vícechlorovaných sloučenin.
Poznámky a odkazy
- vypočtená molekulová hmotnost od „ atomové hmotnosti prvků 2007 “ na www.chem.qmul.ac.uk .
- METHYLCHLORID , bezpečnostní listy Mezinárodního programu pro chemickou bezpečnost , konzultovány 9. května 2009
- Záznam „Methylchlorid“ v chemické databázi GESTIS IFA (německý orgán odpovědný za bezpečnost a ochranu zdraví při práci) ( německy , anglicky ), přístup ke dni 2. února 2010 (je nutný JavaScript)
- (en) Robert H. Perry a Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , str. 2-50
- (en) „Methylchlorid“ , na NIST / WebBook , konzultováno
- (in) Carl L. Yaws, Handbook of Thermodynamic Diagrams , sv. 1, 2 a 3, Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 , 0-88415-858-6 a 0-88415-859-4 )
- (in) David R. Lide, Příručka chemie a fyziky , Boca Raton, CRC,2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 ) , str. 10-205
- Pracovní skupina IARC pro hodnocení karcinogenních rizik pro člověka, „ Globální hodnocení karcinogenity pro člověka, skupina 3: Nezařaditelné z hlediska jejich karcinogenity pro člověka “ , na adrese http://monographs.iarc.fr , IARC,16. ledna 2009(zpřístupněno 22. srpna 2009 )
- Indexové číslo v tabulce 3.1 přílohy VI nařízení ES č. 1272/2008 (16. prosince 2008)
- (in) „ Methylchlorid “ na ChemIDplus , přístup
- „ Methylchlorid “ na adrese hazmap.nlm.nih.gov (přístup 14. listopadu 2009 )
- „Chlormethan“ , na ESIS , přístup 2. února 2010
- Ni X, Hager LP, „ cDNA Cloning of Batis maritima Methyl Chloride Transferase and Purification of the Enzyme “, Proc Natl Acad Sci USA , sv. 95, n o 22,1998, str. 12866–71 ( PMID 9789006 , PMCID 23635 , DOI 10.1073 / pnas.95.22.12866 )
- Ni X, Hager LP, „ Expression of Batis maritima Methyl Chloride Transferase in Escherichia coli “, Proc Natl Acad Sci USA , sv. 96, n o 7,1999, str. 3611–5 ( PMID 10097085 , PMCID 22342 , DOI 10,1073 / pnas.96.7.3611 )
- Nagatoshi Y, Nakamura T (2007) "Charakterizace tří halogenidových methyltransferas v Arabidopsis thaliana" . Plant Biotechnol. 24: 503–506. doi: 10,5511 / plantbiotechnology.24,503.
- „ První detekce Freonu-40 v mezihvězdném médiu s ALMA a Rosettou “ , na CNRS ,2. října 2017(zpřístupněno 11. října 2017 ) .
- (en) Edith C. Fayolle, Karin I. Öberg, K. Jes Jørgensen, Kathrin Altwegg, Hannah Calcutt a kol. , „ Protostellar a kometární počet detekcí organohalogeny “ , Nature astronomie , sv. 1,2017, str. 703-708 ( DOI 10.1038 / s41550-017-0237-7 ).
- (en) Manfred Rossberg, Wilhelm Lendle, Gerhard Pfleiderer, Adolf Tögel, Eberhard-Ludwig Dreher, Ernst Langer, Heinz Rassaerts, Peter Kleinschmidt, Heinz Strack, Richard Cook, Uwe Beck, Karl-August Lipper, Theodore R. Torkelson, Eckhard Löser, Klaus K. Beutel, Trevor Mann, Chlorinated Uhlovodíky , Wiley-VCH Verlag GmbH & Co., al. "Ullmann's Encyclopedia of Industrial Chemistry",15. července 2006( DOI 10.1002 / 14356007.a06_233.pub2 )