Hydroniový ion
| Hydroniový ion | |
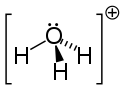   Struktura hydroniového iontu. |
|
| Identifikace | |
|---|---|
| Název IUPAC | oxonium |
| N O CAS | |
| PubChem | 123332 |
| ChEBI | 29412 |
| ÚSMĚVY |
[OH3 +] , |
| InChI |
InChI: InChI = 1S / H2O / h1H2 / p + 1 InChIKey: XLYOFNOQVPJJNP-UHFFFAOYSA-O |
| Chemické vlastnosti | |
| Hrubý vzorec | H 3 O + (vod.) |
| Molární hmotnost | 19,0232 ± 0,0005 g / mol H 15,9%, O 84,1%, |
| pKa | -1,74 při 25 ° C |
| Jednotky SI a STP, pokud není uvedeno jinak. | |
Hydronium iont je nejjednodušší oxoniové ionty ; jeho chemický vzorec je H 3 O +nebo H + (aq). Ve vodném roztoku , je solvatovaná řadou molekul, z vody a může být zapsána H 7 O 3 +, H 9 O 4 +atd. Vyplývá to z protonace části molekuly vody buď s kyselinou , nebo autoprotolýza vody. Existuje také v pevném stavu a v plynném stavu. Je to také iont, který se nachází v mezihvězdném prostředí , kde je výsledkem interakce molekul vody s kosmickým zářením .
Nomenklatura
Podle názvosloví IUPAC pro organické chemie doporučuje se určuje H 3 O + ionby Oxonium . Termín hydroxonium lze také použít pro vyloučení pochybností . Návrh doporučení IUPAC by také doporučil použití termínu oxidan v kontextu anorganické chemie , ale tento název je v současné době v praxi neobvyklý.
Geometrie
Protože iont O + a atom N mají stejný počet elektronů , iont H 3 O +je isoelectronic s molekulou o amoniaku NH 3, proto jeho trigonální pyramidová geometrie s, nahoře, atom kyslíku. Úhel HOH je řádově 113 °.
Řešení
Solvatace hydroniových iontů ve vodě, není dosud plně charakterizovány. Převládající geometrie odvozená z kryoskopie vody by byla H 3 O + (H 2 O) 6 : každý iont je v průměru solvatován šesti molekulami vody, které již nemohou solvatovat jiný iont.
Další solvatační struktury zahrnovat další molekuly vody, zejména H 3 O + (H 2 O) 20ve kterém je hydroniový iont ve středu vodního dvanáctistěnu . Simulace provedené ab initio metody z kvantové chemie by však ukazují, že se jedná o hydratovanou proton bude umístěn v průměru spíše na povrchu H 3 O + (H 2 O) agregát 20.
Kalifornský tým navrhl v roce 2010 nový model založený na analýze infračervené spektroskopie, podle kterého jsou protony solvatovány ve formě agregátů [H 13 O 6 ] +ve kterém by byl kladný elektrický náboj distribuován bez rozdílu mezi šest molekul vody.
H 3 O + monomerkapalná fáze byla identifikována v roce 1979 nukleární magnetickou rezonancí v kyslíku 17 v roztoku superkyseliny slabě nevodné nukleofilní HF-SbF 5 SO 2( fluorovodík , pentafluorid antimonitý , oxid siřičitý ).
Oxoniový iont je trvale přítomen ve vodě v důsledku autoprotolýzy :
- Nejprve dochází k disociaci molekuly vody: H 2 O H + + HO -
- Poté druhá molekula vody solvatuje uvolněný proton: H 2 O+ H + H 3 O +
- A konečně, solvatované proton získá tzv oxoniové iontů , se hydratuje v roztoku, a proto označeny H 3 O + (aq), zkráceně jako „vodný“ ve smyslu skutečnosti, že je v roztoku.
Celkové reakční schéma lze napsat:
2 H 2 O H 3 O + (aq) + HO - (aq)HO - (aq)je hydroxidový iont , také solvatovaný.
pH čisté vody při 25 ° C
Rovnovážná konstanta z autoprotolýza vody při 25 ° C je:
K eq = [H 3 O +] X [HO - ] / [H 2 O] 2 = 10–14 .Rovnovážná konstanta se nevztahuje na koncentrace, ale na činnosti. Aktivita vody H 2 O rozpouštědlo je rozpouštědlo prakticky čisté kapaliny a podle konvence se rovná 1.
Ionizační konstanta vody při 25 ° C je zapsána:
K e = K eq x [H 2 O] 2 = [H 3 O +] × [HO - ] = 10 -14 ,což znamená, že :
[H 3 O +] = [HO - ] = 10 -7 ,tedy hodnota pH čisté vody při 25 ° C :
pH = - log 10 ([H 3 O +]) = 7.Oxoniový iont je odpovědný za vlastnosti kyselin podle definice Joannes Brønsted . Je přítomen v jakémkoli vodném roztoku v rovnováze s hydroxidovým iontem HO - . Jedná se o měření jeho koncentrace, které umožňuje určit pH roztoku.
Reference
- [1]
- vypočtená molekulová hmotnost od „ atomové hmotnosti prvků 2007 “ na www.chem.qmul.ac.uk .
-
(en) Jian Tang a Takeshi Oka , „ Infračervená spektroskopie H 3 O +
: The ν 1 Fundamental Band ” , Journal of Molecular Spectroscopy , sv. 196, n o 1,Červenec 1999, str. 120-130 ( číst online )
DOI : 10,1006 / jmsp.1999,7844 -
DOI : 10.1021 / ja9101826 -
(in) Gheorghe D. Mateescu, George M. Benedikt , „ Voda a související systémy. 1. Hydroniový ion (H 3 O +
). Prepartion a charakterizace pomocí nukleární magnetické rezonance s vysokým rozlišením kyslíku-17 “ , Journal of the American Chemical Society , sv. 101, n o 14,1979, str. 3959-3960 ( číst online )
DOI : 10.1021 / ja00508a040
