Vylučovací reakce
V organické chemii je eliminace (nebo β-eliminace ) organická reakce, která transformuje substituovaný alkan ( haloalkany , alkoholy atd.) Na ethylenový derivát nebo dokonce na alken , pokud je výchozí molekulou, kromě odcházející skupiny , n 'je pouze uhlíkový řetězec alkanového typu.
Podmínky jsou, kromě drsných, podmínky nukleofilní substituce , reakce podobná v mnoha ohledech a souběžná: k eliminaci dochází v přítomnosti silné báze a zahříváním reakční směsi.
Obecná rovnice
Jedním z hlavních příkladů eliminace je přeměna haloalkan až k alkenu ; pak mluvíme o dehydrohalogenaci :
Mezi nejčastěji používané báze jsou sody (Na + , HO - ), potaš (K + , HO - ), nebo dokonce alkoholát ionty (RO - ) (získané reakcí sodíku v alkoholu ROH, bezvodý ).
Stejně jako u nukleofilní substituce existuje monomolekulární eliminace a bimolekulární eliminace, které se běžně označují jako El, respektive E2.
Ve zbývající části tohoto článku jsou uvedeny příklady halogenovaného derivátu jako činidla.
Monomolekulární eliminace
Kinetika E1
Monomolekulární eliminační reakce se provádí ve dvou stupních: monomolekulární stupeň, který zahrnuje pouze molekulu halogenovaného derivátu na straně reaktantu, což je kineticky omezující stupeň, následovaný bimolekulárním stupněm. V důsledku toho kinetika reakce, v aproximaci kineticky určujícího (nebo omezujícího ) kroku, závisí pouze na koncentraci druhu RX.
Reakce je proto charakterizována kinetikou celkového řádu 1, dílčích řádů 1 vzhledem k halogenovanému derivátu a 0 vzhledem k bázi B | : v = k. [RX] , kde:
- [RX] představuje koncentraci halogenovaného derivátu v mol.L -1
- v představuje rychlost eliminační reakce. Vyjadřuje se v mol.s -1 .
- k je rychlostní konstanta: ve skutečnosti jde o kineticky omezující krok (k 1 ). Jeho jednotka, Ls −1 , je odvozena od jednotek ostatních dvou termínů.
Mechanismus E1
Reakce probíhá ve dvou fázích.
- První krok: odchod nukleofugy, tvorba karbokationtu. tento krok tvorby karbokace je pomalý, reverzibilní krok a ukládá svou rychlost celé reakci.
- Druhý krok: acidobazická reakce. Základna protrhává proton. Dublet se poté „přeloží“ přes vazbu uhlík-uhlík a vytvoří dvojnou vazbu . Jelikož se jednoduchá vazba uhlík-uhlík může otáčet, mohou se vytvořit dva stereoizomery. Protože tato reakce je mnohem rychlejší než předchozí, její rychlost neovlivňuje celkovou rychlost.

Stereoselektivita a regioselektivita
StereochemieJak ukazuje mechanismus, průchod karbokationtem, což je planární struktura, odstraňuje jakýkoli prvek stereospecificity na rozdíl od (viz níže) mechanismu bimolekulární eliminace.
Pokud však mohou vzniknout dva geometrické stereoiseomery, netvoří se ve stejných poměrech. Nejstabilnější izomer, to znamená ten s nejnižší energií, se tvoří převážně (to je Zaitsevovo pravidlo). Je to tedy E izomer, který se tvoří hlavně bez mesomery. Na druhou stranu, pokud lze dvojitou vazbu pouze jednoho ze dvou produktů delokalizovat pomocí mesomery, pak se bude tvořit hlavně tato. Tomu se říká částečná stereoselektivita.
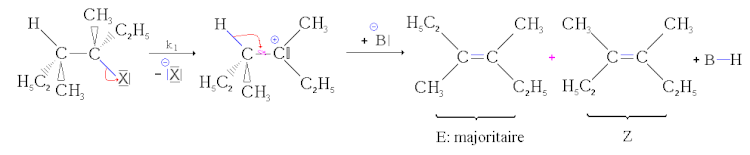 Regiochemie
Regiochemie
Pokud lze vytvořit několik konstitučních izomerů, výhodně se vytvoří termodynamicky nejstabilnější alken. Pokud existují pouze alkylové skupiny, jedná se o nejvíce substituovaný alken. Pokud může mesomeria zasáhnout, je to nejvíce konjugovaný alken, který je ve většině. Toto se označuje jako regioselektivita nebo Zaïtsevovo pravidlo .
Někdy se však přednostně tvoří méně termodynamicky stabilní alken, což se označuje jako Hofmannova eliminace . To platí zejména v případě, že je použitá báze přetížená (např. KtBuO) nebo když je například vyloučen amonný iont. (Molekula nesoucí amin v přítomnosti MeI v řadě ekvivalentů dostatečných k vytvoření amonné soli, poté umístěná do přítomnosti mokrého a zahřátého oxidu stříbrného . Tvorba alkenu eliminací Hofmanna a tedy odchodem N (Me ) 3.)
Faktory ovlivňující reakci
Parametry ovlivňující eliminaci E1 jsou:
- účinek R-: kineticky určujícím krokem je tvorba karbokationtu (a ne jeho reaktivita), proto čím více je stabilní, tím více je reakce upřednostňována.
- nukleofuga: štěpení vazby opouštějící skupinu C je klíčovým krokem v mechanismu, reakce silně závisí na povaze této nukleofugy. Čím lepší je výchozí skupina, tím rychlejší je reakce. Například pro dehydrataci alkoholů, prvním krokem je protonace alkoholu za vzniku oxoniové, a proto je lepší odstupující skupinu (H 2 O⇒HO - ). Rychlé pořadí výchozích skupin by bylo:
(značka „>“ znamená: „nejlepší výchozí skupina než“)
Všimněte si, že základna neovlivňuje tento typ reakce řádu 1 a to do té míry, že nezasahuje během prvního kroku, který určuje celkovou rychlost reakce.
Alkylová skupina halogenového derivátuMechanismus prochází reakčním meziproduktem typu karbokace. Ten je o to stabilnější, čím více je nahrazován. Reakční rychlost (tedy tvorba karbokationtu) tedy postupuje od primárních derivátů k sekundárním a poté k terciárním. V praxi tímto mechanismem reaguje pouze ten druhý a několik sekundárních derivátů.
NucleofugeČím polarizovatelnější je spojení RX, tím snazší je jeho přerušení. Tato vazba má tedy klesající labilitu („křehkost“) z fluoru na jód: F> Cl> Br> I.
(symbol „>“ znamená: „rychlejší než“)
Solventní- Polarita: polární rozpouštědlo stabilizuje karbokation; usnadňuje tak první reakci. Rychlost se proto zvyšuje s polaritou rozpouštědla.
- Proticita: protické rozpouštědlo je spíše handicap: ve skutečnosti riskuje, že během (silné) acidobazické reakce bude konkurovat karbokationtu.
Soutěž
Tato reakce nejen soutěží s druhou eliminací, ale také s reakcemi nukleofilních substitucí, zejména s S N 1 . K druhému dochází ve skutečnosti za podobných podmínek (kromě vytápění).
Bimolekulární eliminace
Kinetický
Bimolekulární eliminační reakce má kinetiku globálního řádu 2 a částečného řádu 1 s ohledem na halogenovaný derivát RX a na bázi B: - . Reakce probíhá v jediném kroku, který je bimolekulární. Rychlost reakce se tedy řídí typovým zákonem: v = k. [RX]. [B: - ] .
nebo:
- [RX] představuje koncentraci halogenovaného derivátu (vyjádřeno v mol.L -1)
- [B: - ] představuje základní koncentraci (vyjádřenou v mol.L −1 )
- v představuje rychlost eliminační reakce. Vyjadřuje se v mol.s -1 .
- k je rychlostní konstanta. Jeho jednotka, Ls −1 .mol −1 , je odvozena od jednotek ostatních dvou termínů.
Mechanismus E2
Bimolekulární eliminace je jednokroková bimolekulární reakce.
Během stejného elementárního kroku dochází k odtržení protonu bází, tvorbě dvojné vazby a odchodu atomu halogenu (nukleofúga) ve formě halogenidového iontu. Mluvíme o synchronním nebo koordinovaném mechanismu.
Stereochemie
E2 je stereospecifická reakce .
Reakce probíhá pouze tehdy, když jsou vodík a odstupující skupina v antipleurplanární poloze .
Faktory ovlivňující reakci
- Reakční rychlost E2 se liší jen mírně v závislosti na třídě (primární: I, sekundární: II, terciární: III) uvažovaného halogenidu. Čím vyšší je třída, tím rychlejší je reakce (III> II> I) ze stérických důvodů (eliminace umožňuje odstranit objemné, a tedy „objemné“, substituenty v konečném produktu, přítomném v původním produktu, činidle , protože v tomto případě prochází z valenčního úhlu 109 ° 28 ', na úrovni uhlíku „sp 3 “, nesoucí proton H, ve valenčním úhlu 120 °, v konečném produktu, kde je stejný uhlík nyní "hybridizovaný sp 2 "). V tomto případě se obecně dává přednost primárnímu haloalkanu, ale pokud je v přítomnosti sekundárního haloalkanu, reakce typu E1 a E2 se liší potenciálními mezomerními účinky („mesomerový“ účinek: obecný pojem definující elektronický účinek odpovídající k delokalizaci náboje, zde kladného, na arylové skupině, například bezprostřední soused, tedy „v α“, přerušené CH vazby, se hovoří o „deprotonaci“ silnou bází). Jakýkoli substituent na uhlíkovém řetězci schopný stabilizovat karbeniový ion (C + karbokation ) prostřednictvím tohoto typu elektronického efektu bude podporovat mechanismus E1.
- Reakční rychlost se zvyšuje s pevností báze, takže je potřeba silná báze.
- Nukleofugní charakter odstupující skupiny má také vliv na reakci, ale tento vliv není primárním parametrem na rozdíl od unimolekulárního eliminačního mechanismu (E1).
- Pro podporu reakčního mechanismu eliminace bimolekulárního E2 je rozumné použít aprotické rozpouštědlo (DMSO, THF, toluen, n-hexan atd.)
Soutěž
Tato reakce nejen že s E1, ale také s nukleofilní substituční reakce, zejména s S N 2 , která se vyskytuje za podobných podmínek. Pamatujte, že eliminační reakce bude vyžadovat více energie než odpovídající substituční reakce, obvykle zahříváním.
Poznámky
Použitá báze je také nukleofil . To vysvětluje konkurenci s reakcemi substitucí. Na konci reakce lze najít smíšené, eliminační produkty a náhradní produkty.