NADH dehydrogenáza
NADH dehydrogenáza (ubichinon)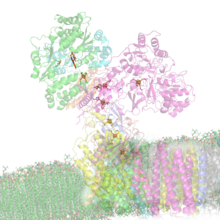 Struktura NADH dehydrogenázy zdůrazňující intramolekulární elektronové transportéry ( PDB 2FUG ). Pozorujeme sedm vyrovnaných shluky železa síry umožňující cirkulaci elektronů z NADH v mitochondriální matrix (nahoře), přes na FMN kofaktor , k ubichinonu , převede na ubichinol , ve vnitřní mitochondriální membráně (dole).
Struktura NADH dehydrogenázy zdůrazňující intramolekulární elektronové transportéry ( PDB 2FUG ). Pozorujeme sedm vyrovnaných shluky železa síry umožňující cirkulaci elektronů z NADH v mitochondriální matrix (nahoře), přes na FMN kofaktor , k ubichinonu , převede na ubichinol , ve vnitřní mitochondriální membráně (dole).
| Č. ES | ES |
|---|---|
| Číslo CAS | |
| Kofaktor (y) | FMN ; Fe-S |
| IUBMB | Vstup IUBMB |
|---|---|
| IntEnz | IntEnz pohled |
| BRENDA | Vstup BRENDA |
| KEGG | Vstup KEGG |
| MetaCyc | Metabolická cesta |
| PRIAM | Profil |
| PDB | Struktury |
| JÍT | AmiGO / EGO |
NADH dehydrogenázy nebo komplex I z dýchacího řetězce je oxidoreduktázy membrána , která katalyzuje na reakci :
NADH + ubichinon + 5 H + matice NAD + + ubichinol + 4 H + mezimembrána .Tento enzym je přítomen ve velkém počtu živých bytostí, od prokaryot až po člověka . Představuje první vstupní bod pro elektrony s vysokým přenosovým potenciálem do buněčného dýchání a oxidační fosforylace v mitochondriích a zajišťuje přenos elektronů z NADH na koenzym Q 10rozpuštěný v lipidové dvojvrstvě . U eukaryot se nachází ve vnitřní mitochondriální membráně . Rovněž by hrálo roli při spouštění apoptózy ; byla zjištěna korelace mezi aktivitou mitochondrií a apoptózou během somatického vývoje embrya .
Struktura a provoz
Komplex I je největší a nejkomplikovanější enzym v dýchacím řetězci. V savců , že se skládá z 44 polypeptidových řetězců , z nichž sedm jsou kódovány do mitochondriálního genomu . Obsahuje zejména protetickou skupinu FMN a osm shluků železa a síry , z nichž sedm je vyrovnáno tak, aby umožňovalo cirkulaci elektronů z NADH do koenzymu Q 10. Přenos těchto elektronů z redoxního páru, jehož standardní potenciál je -0,32 V, na redoxní pár, jehož standardní potenciál je 0,06 V, uvolní dostatek energie k aktivaci protonové pumpy vylučující čtyři H + protony z mitochondriální matice do intermembránového prostoru vnitřním membrána mitochondrií.
Obecná struktura přijímá tvar L s dlouhou membránovou doménou skládající se z asi šedesáti šroubovic a periferní hydrofilní doménou, kde se nacházejí všechna redoxní centra a vazebné místo NADH. Struktura komplexu I eukaryot není dosud dobře charakterizována jako celek, ale byla stanovena struktura hydrofilní domény bakterie Thermus thermophilus (en) ( PDB 2FUG ) a membránových domén E. coli ( PDB 3RKO ) a T. thermophilus ( PDB 4HE8 ). Kompletní struktura NADH dehydrogenázy T. thermophilus byla poprvé publikována vúnor 2013( PDB 4HEA ).
-
( Fr ) Funkční schéma NADH dehydrogenázy ukazuje jeho obecný tvar sestávající z hydrofilní domény (dole) koupal v mitochondriální matrix a vyznačuje sedmi seřazených železo-síra se seskupí pohánějících elektrony z matrice NADH prostřednictvím s FMN protetické skupiny, do hydrofobní doména (nahoře) obsažená ve vnitřní mitochondriální membráně a ve které koenzym Q 10je redukován v ubichinolu Q 10 H 2. Čtyři H + protony jsou během této reakce vyloučeny do mitochondriálního mezimembránového prostoru , což pomáhá vytvářet gradient protonové koncentrace přes vnitřní mitochondriální membránu.
Inhibitory
Rotenon je inhibitor nejznámější z komplexu I . Běžně se používá jako pesticid a jako insekticid . S isoflavonoidy (in) jsou rotenoidy přítomny v mnoha druzích tropických rostlin, jako jsou Antonia ( Loganiaceae ), Derris a Lonchocarpus ( Faboideae , Fabaceae ). Stejně jako piericidin A (fr) , rotenon se váže na vazebné místo k ubichinonu z komplexu I .
Adenosin difosfát ribóza (ADPR) je také inhibitorem NADH dehydrogenázy vazbou na vazebné místo nukleotidu, který blokuje vazbu na NADH .
Rodina acetogeniny jako nejsilnějších inhibitorů komplexu I . Tyto molekuly se vážou na podjednotku ND2, což ukazuje, že tato molekula by byla nezbytná pro vazbu ubichinonu. Jedna z těchto molekul, rolliniastatin-2, je prvním komplexním inhibitorem I , který se neváže na stejné místo jako rotenon.
Metformin , An antidiabetikum , je také částečný inhibitor komplexu I , který se zdá hrají kritickou roli v jeho působení.
Poznámky a odkazy
- (in) Leonid A. Sazanov a Philip Hinchliffe , „ Struktura hydrofilní domény dýchacího komplexu I z Thermus thermophilus “ , Science , sv. 311, n O 5766, 10. března 2006, str. 1430-1436 ( PMID 16469879 , DOI 10.1126 / science.1123809 , Bibcode 2006Sci ... 311.1430S , číst online )
- (en) Eiko Nakamaru-Ogiso, Hongna Han, Akemi Matsuno-Yagi, Ehud Keinan, Subhash C. Sinha, Takao Yagi a Tomoko Ohnishi , „ Struktura hydrofilní domény dýchacího komplexu I z Thermus thermophilus “ , FEBS Dopisy , roč. 584, n o 5, 5. března 2010, str. 883-888 ( PMID 20074573 , PMCID 2836797 , DOI 10.1016 / j.febslet.2010.01.004 , číst online )
- (in) Maria a Peter Chomova Racay , „ Mitochondriální komplex I v síti známých a neznámých skutečností “ , General Physiology and Biophysics , Vol. 29, n o 1, března 2010, str. 3-11 ( PMID 20371875 , DOI 10.4149 / gpb_2010_01_3 , číst online )
- (in) Elisa Petrussa Alberto Bertolini, Valentino Casolo Jana Krajňáková Francesco Macrì a Angelo Vianello , „ Mitochondriální bioenergetika spojená s projevem programované buněčné smrti během somatické embryogeneze Abies alba “ , Planta , sv. 231, n o 1, prosince 2009, str. 93-107 ( PMID 19834734 , DOI 10.1007 / s00425-009-1028-x , číst online )
- (in) Ulrich Brandt , „ Energy Converting NADH: chinone oxidoreductase (Complex I) “ , Annual Review of Biochemistry , sv. 75, července 2006, str. 69-92 ( PMID 16756485 , DOI 10.1146 / annurev.biochem.75.103004.142539 , číst online )
- (in) Joe Carroll, Ian M. Fearnley, J. Mark Skehel1 Richard J. Shannon, Judy Hirst a John E. Walker2 , „ Bovine Complex I is a Complex of 45 Subunits “ , Journal of Biological Chemistry , sv. 281, n o 43, 27. října 2006, str. 32724-32727 ( PMID 16950771 , DOI 10.1074 / jbc.M607135200 , číst online )
- (in) Eduardo Balsa Ricardo Marco, Ester-Perales Clemente, Radek Szklarczyk Enrique Calvo, Manuel O. Landázuri a José Antonio Enríquez , „ NDUFA4 Is a Complex Subunit of Mammalian IV of the Electron Transport Chain “ , Cell Metabolism , vol. 16, n o 3, 5. září 2012, str. 378-386 ( PMID 22902835 , DOI 10.1016 / j.cmet.2012.07.015 , číst online )
- (in) Rozbeh Baradaran, John M. Berrisford, Gurdeep S. Minhas a Leonid A. Sazanov , „ Krystalová struktura celého dýchacího komplexu I “ , Nature , sv. 494, n O 7438, 28. února 2013, str. 443-448 ( PMID 23417064 , PMCID 3672946 , DOI 10.1038 / nature11871 , Bibcode 2013Natur.494..443B , číst online )
- (in) Tatyana V. Zharova a Andrei D. Vinogradov , „ Competitivehibition of the mitochondrial NADH-ubiquinone oxidoreductase (Complex I) by ADP-ribose “ , Biochimica et Biophysica Acta (BBA) - Bioenergetics , sv. 1320, n o 3, 4. července 1997, str. 256-264 ( PMID 9230920 , DOI 10.1016 / S0005-2728 (97) 00029-7 , číst online )
- (in) Mr. Degli Esposti, A. Ghelli Mr Ratta, D. a E. Cortes Estornell , „ Přírodní látky (acetogeniny) z čeledi Annonaceae jsou silnými inhibitory mitochondriální NADH dehydrogenázy (komplex I) “ , Biochemical Journal , sv. . 301, n o 1, Červenec 1994, str. 161-167 ( PMID 8037664 , PMCID 1137156 , DOI 10.1042 / bj3010161 , číst online )
- (in) Benoit Viollet Bruno Guigas, Nieves Garcia Sanz, Jocelyne Leclerc, Marc Foretz a Fabrizio Andreelli , „ Buněčné a molekulární mechanismy metforminu: přehled “ , Clinical Science , sv. 122, n O 6, března 2012, str. 253-270 ( PMID 22117616 , PMCID 3398862 , DOI 10.1042 / CS20110386 , číst online )
