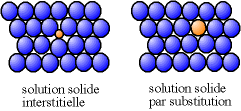Slitina
Slitina je kombinace kovového prvku s jedním nebo více kovů fúze.
Mechanické vlastnosti čistých kovů jsou většinou relativně nízké. Skutečnost přidání dalších prvků umožňuje „vytvrzení“ kovu při zvýšení jeho mechanických vlastností. Kromě mechanických výztuží generovaných deformací, jako je vytvrzování při práci , existuje chemické vytvrzování přidáním prvků v pevném roztoku nebo vysrážením sekundárních fází vytvrzování, jako jsou karbidy . Tyto doplňky také umožňují upravit chemické vlastnosti, jako je odolnost proti korozi , nebo zlepšit další vlastnosti, například tekutost .
Ve slitině se hlavní kovový prvek, tj. Tvořící nejdůležitější část směsi, nazývá „základní kov“ nebo „základ“. Prvky přidané záměrně se nazývají „legující prvky“ nebo „přídavné prvky“ a nežádoucí prvky se nazývají „nečistoty“.
Slitinové prvky jsou nejčastěji kovy, ale mohou to být i jiné chemické prvky, jako je uhlík v oceli nebo litině , křemík v hliníku atd.
Pokud legujícím prvkem není kov, zůstává jeho obsah obvykle nízký (maximálně několik hmotnostních%). U oceli je tedy koncentrace uhlíku nižší než 2% hmotnostní (u litiny méně než 7% hmotnostních), přičemž je možné vyrobit slitinu měď - zinek (běžně nazývanou mosaz ) s 50% každý z prvků.
Dějiny
Existují také takzvané přírodní slitiny, například elektrum , slitina nativního zlata a stříbra používané v pravěku a starověku : mimo jiné Varna , Malá Asie , Ur , Egypt . Na III th století před naším letopočtem. AD , v práci na kamenech , filozof Theophrastus vysvětluje název slitiny je stanovena v collybos , drachmách nebo půl drachmy - nebo dokonce ječných zrn .
Binární slitina
Jednofázová binární slitina
Homogenní slitina se skládá z jediné homogenní pevné fáze . Pro získání homogenní slitiny musí být mezi slitinovými prvky úplná mísitelnost . Existují dvě možnosti:
- Dva legující prvky jsou navzájem rozpustné bez ohledu na jejich příslušné proporce.
- Koncentrace legujícího prvku je pod mezí rozpustnosti.
Pravidla Hume-Rothery označují podmínky pro získání homogenní slitiny s celkovou rozpustností v pevném stavu.
| Živel | Atomový poloměr |
Krystalová struktura |
|---|---|---|
| Vizmut | 160 hodin | Rhombohedral |
| Antimon | 145 hodin | Rhombohedral |
Bismutu a antimonu jsou zcela rozpustné v sobě. Tvoří proto pevný roztok bez ohledu na chemické složení a teplotu (za podmínky, že zůstanou v pevném stavu, tj. Pod teplotou solidu ). Výsledný fázový diagram je v tomto případě jedna zóna diagram.
Jiné páry kovů mají dobrou mísitelnost, což umožňuje získat pevné roztoky, které jsou za určitých teplot homogenní: měď - nikl , měď - palladium , stříbro - zlato , stříbro - palladium, molybden - vanad , molybden - wolfram atd.
Některé binární slitiny vykazují při nízkých teplotách defekt nízké rozpustnosti. Na fázovém diagramu se objevuje sektor, kde koexistují dvě fáze, první sestává z pevného roztoku nasyceného B v A a naopak druhá fáze sestává z pevného roztoku nasyceného A v B. Je to například případ systém měď-nikl, který představuje pod 322 ° C zónu se dvěma fázemi.
Vícefázová binární slitina
Dalším typem fázového diagramu relativně běžného v binárních slitinách je eutektický fázový diagram. Tento typ fázového diagramu vykazuje řadu důležitých charakteristik, které je třeba poznamenat. Nejprve jsou na schématu viditelné tři jednofázové oblasti: α, β a kapalina. Na obrázku vlevo je fáze α pevný roztok bohatý na měď, který má jako rozpuštěnou látku stříbro a má buňku struktury CFC ( face-centered cubic ). Fáze β (pevný roztok) se také vyznačuje strukturou CFC, ale pro kterou je měď solutem.
Rozpustnost adičního prvku v každé z těchto pevných fází je tedy omezená. Jinými slovy, koncentrace stříbra, které se může rozpustit v mědi (pro fázi α) bez úpravy její krystalografické struktury, je omezená. Ze stejného důvodu je přidávání mědi ke stříbře (β fáze) omezené. Mez rozpustnosti fáze α odpovídá dělicí čáře označené „CBA“.
Pro teploty pod 779 ° C ( 1434 ° F ) se čára odpovídající limitu rozpustnosti v pevné látce, která odděluje oblast α fáze a oblast koexistence fází α + β, nazývá čára solvus. Hranice oddělující fázi α a oblast α + L je čára solidu (AB), zatímco čára oddělující oblast α + L a kapalnou doménu je čára likvidu (AE). Pro část fázového diagramu bohatou na stříbro existují také tři řádky: solvus (HG), solidus (GF) a likvidus (EF). Vodorovná čára BEG, která je rovnoběžná s osou úsečky, se táhne mezi příslušnými maximy rozpustnosti fází a a p. Nazývá se eutektické ložisko a lze jej také považovat za čáru solidu, představující nejnižší teplotu, při které může při termodynamické rovnováze pro jakoukoli slitinu mědi a stříbra existovat kapalná fáze.
V systému měď-stříbro se také nacházejí tři dvoufázové oblasti. Když se do mědi přidává stříbro, teplota, při které se slitiny stanou zcela kapalnými, klesá podél linie likvidu (linie AE); tak se teplota tání mědi sníží přidáním stříbra. Je to stejný princip pro slitiny, ve kterých je většinovou sloučeninou stříbro: zavedení mědi snižuje celkovou teplotu tání podél linie likvidu FE. Tyto čáry likvidu reagují na bod E na fázovém diagramu, kterým prochází také vodorovná izotermická čára BEG. Bod E je eutektický bod, který je označen složením EC a teplotou TE; pro systém měď-stříbro jsou hodnoty CE a TE 71,9% hmotn. Ag a 779 ° C ( 1434 ° F ).
Důležitá reakce probíhá ve slitině složení „CE“, avšak při průchodu TE mění teplotu. Při chlazení se kapalná fáze transformuje na dvě pevné fáze (α a β) při teplotě TE, k reverzní reakci dochází při zahřívání. Toto se nazývá eutektická reakce (eutektické prostředky se snadno taví) a CE a TE představují eutektické složení a teplotu. Horizontální čára solidu v TE se často nazývá eutektická izoterma. Eutektická reakce je po ochlazení podobná tuhnutí čistých složek v tom, že reakce probíhá při konstantní teplotě nebo izometricky při TE. Pevným produktem eutektického tuhnutí jsou však vždy dvě pevné fáze, zatímco u jedné složky se tvoří pouze jedna fáze. Kvůli této eutektické reakci se fázové diagramy podobné těm na obrázku Ag-Cu diagramu označují jako eutektické fázové diagramy.
Při konstrukci binárních fázových diagramů je důležité si uvědomit, že jedna nebo nejvýše dvě fáze mohou být v oblasti fáze v rovnováze. U eutektického systému mohou být tři fáze (α, β a L) v rovnováze, ale pouze v bodech podél eutektické linie.
Existují tisíce možných kombinací fázových diagramů s více fázemi. Některé z hlavních rysů fázových diagramů zahrnují shodné body, kde se pevná fáze přímo promění v kapalinu. Existuje také peritektoidní bod, pro který se pevná fáze po zahřátí změní na dvě pevné fáze odlišné od počáteční pevné fáze. Naopak, pokud k transformaci dochází během ochlazování, mluvíme o eutektoidním bodě.
Složitým fázovým diagramem velkého technologického významu je diagram systému železo-uhlík s méně než 7% uhlíku.
Osa X takového diagramu odpovídá měnící se koncentraci směsi. Jelikož směsi obecně nejsou daleko od oslabení a jejich hustota jako funkce teploty není obecně známa, je výhodným měřením molární koncentrace. Schéma založené na objemu měření jako molaritě by se nedoporučovalo.
Struktura
Homogenní slitina
Doplňkový prvek, který tvoří pevný roztok s obecným kovem, může být umístěn buď mezi atomy většinového prvku (hovoříme o „vložení“), nebo místo atomů většinového kovu (hovoříme o „substituci“) ").
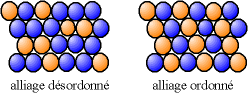
Substituce může vést buď k neuspořádané slitině , kde různé atomy zaujímají náhodné polohy, nebo k uspořádané slitině , kde atomy různé povahy sledují pravidelné střídání.
Heterogenní slitina
Když se obsah legujících prvků zvýší, mohou se vytvořit dvě fáze: fáze obsahující několik legujících prvků a fáze s vysokým obsahem legujících prvků. Krystalitů vysoký stupeň se nazývá „uspěchané“.
Tyto sraženiny jsou často nařízeno slitiny s názvem „intermetalických“. Takto vytvořené intermetaliky jsou někdy následně studovány jako čisté slitiny, jako nový materiál, a my se je snažíme vyrábět jako takové a už ne jako sraženiny.
Příklady
Hlavní slitiny
Slitiny železa- litina : železo + uhlík (více než 1,7% a až 4% hmotnosti uhlíku)
- ocel : železo + uhlík (méně než 2,1% hmotnostních uhlíku) (+ možné stopy niklu , chrómu , molybdenu v malém procentu (<4%))
- nerezová ocel : železo + uhlík + nikl + chrom a někdy molybden, vanad
- bronz : měď + cín ; „ mosaz “ je starý název pro bronz
- mosaz : měď + zinek
- billon : měď + stříbro ; používá se hlavně k ražení mincí nízké hodnoty
Nazývají se také lehké slitiny kvůli hustotě hliníku ve srovnání s hustotou jiných kovů.
Další podrobnosti najdete ve dvou článcích níže:
Méně známé slitiny
- slitina olovo-cín : pro pájení
- elektrum : zlato + stříbro
- amalgám : rtuť + jiný kov, například zlato nebo měď; tento výraz také označuje směs kovů používaných pro péči o zuby („výplň“)
- nikl stříbro : měď + zinek + nikl
- monel (obchodní název): nikl + měď
- reguluje : cín nebo olovo + antimon
- ruolz : nikl + stříbro + měď
- tumbaga : slitina zlata a mědi používaná předkolumbovskými civilizacemi v Jižní Americe a Střední Americe .
- zamak : zinek + hliník + hořčík + měď a další " ZL " (hlavní součásti: zinek a hliník )
- virenium : měď + zinek + nikl
Slitiny pro specifické aplikace
- ferrotitany : železo + 25 až 70% Ti + 4 až 10% hliníku
- TA6V: titan + 6% hliník + 4% vanad, široce používaný v leteckém průmyslu
- MCrAl: kov + chrom + hliník + někdy ytrium (MCrAlY), slitiny známé svou dobrou mechanickou pevností a odolností proti korozi při vysokých teplotách
- FeCrAl: železo + chrom + hliník
- NiCrAl: nikl + chrom + hliník
- niklové superslitiny (například inconels ): dobrá mechanická pevnost a odolnost proti korozi při vysoké teplotě
-
intermetalické : uspořádané slitiny, respektující přesnou stechiometrii (ale odchylky od stechiometrie jsou tolerovány)
- NiAl β: 50% nikl + 50% hliník
- FeAl B2: 50% železo + 50% hliník
- TiAl: 50% titan + 50% hliník
- Slitiny s nízkými koeficienty roztažnosti (vytvořil Charles Édouard Guillaume )
- FeNiCo slitina 54% železo + 29% nikl + 17% kobalt určená k utěsnění skla / kovu nebo keramiky / kovu
Reference
- Henri Godfroid , Metalurgie pro mechaniku: Obecné vlastnosti slitin, jejich tepelné zpracování , Paříž, La Chapelle-Montligeon, Impr. de Montligeon, kol. "Mechanical Publications Company",1950( dotisk 1959), In-8 ° (240 × 160), 378 str., obr., pl. 2 000 fr. [DL 4455] ( BNF oznámení n o FRBNF32174558 ) ( BNF oznámení n o FRBNF32174559 )
- Ve starořečtině Περὶ Λίθων .
- ve starořečtině κολλυβος .
- Frag. 46, vyd. Wimmer: on retuše, přesnost je zde stater of Cyzicus .
- (in) William Callister , Základy vědy o materiálech a inženýrství: interaktivní etext , New York, Wiley ,2001( 1 st ed. 5), 524 str. ( ISBN 978-0-471-39551-5 , OCLC 761975075 ) , s. 292-295.
Poznámky
- Obvyklé francouzské označení TA6V vychází ze starého standardu NF A 02-004, který byl nyní zrušen, jeho chemické označení je Ti Al 6 V.
Podívejte se také
Různé slitiny
- AlNiCo magnet
- mosaz
- hliníková slitina pro tepané železo
- hliníková slitina pro slévárenství
- slitina mědi
- slitina devarda
- Slitina Heusler
- slitina titanu
- amorfní kovová slitina
- slitina zlata a mědi
- slitina olova a cínu
- slitina plutonia a gália
- Alumel
- Britannia peníze
- Mincovní stříbro
- galium-hliníkový arzenid
- billon (slitina)
- britannium
- bronz (slitina mědi a cínu)
- berylium bronz
- Korintský bronz
- Fosforově bronzová
- chromel
- Constantan
- kunife
- měďnatý hliník
- cupronickel
- duralium
- elektrum
- elektron
- cín
- Fernico
- feroslitina
- litina (metalurgie)
- galinstan
- Hastelloy
- invar
- Kanthal
- kovar
- mosaz
- ledbitis
- niklové stříbro
- magnalium
- dřevo kov
- moldamax , slitina měď-berylium
- monel
- nichrom
- nikl
- Raney nikl
- Nigusil
- Niresist
- Nitinol
- bílé zlato
- Severské zlato (někdy nazývané „severská slitina“)
- orichalcum
- partinium
- Peraluman
- permalloy
- pazourek
- knihtisk olovo
- drby
- Reynolds 531 , slitina manganu a molybdenu
- ruolz
- shakudo
- stellit (slitina)
- Titanal
- tumbaga
- Zamak
- zicral