Fosfát
| Fosfát | |
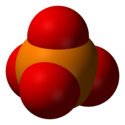 Trojrozměrná struktura fosfátového iontu Struktura fosfátové skupiny navázané na radikál R.  |
|
| Identifikace | |
|---|---|
| N O CAS | |
| PubChem | |
| ÚSMĚVY |
[O-] P (= O) ([O -]) [O-] , |
| InChI |
InChI: InChI = 1 / H3O4P / c1-5 (2,3) 4 / h (H3,1,2,3,4) / p-3 / fO4P / q-3 |
| Chemické vlastnosti | |
| Vzorec | PO 43− |
| Molární hmotnost | 94,9714 ± 0,0012 g / mol O 67,39%, P 32,61%, |
| Jednotky SI a STP, pokud není uvedeno jinak. | |
Fosfát je sloučenina odvozená od kyseliny fosforečné H 3 PO 4 ztrátou nebo substitucí jednoho nebo více jeho vodíků jinými atomy nebo funkčními skupinami.
V minerální chemii je to sůl , která je výsledkem napadení báze touto kyselinou, nebo anion, který je součástí této soli. Orthofosforečnan ionty jsou nejčastější chemické formy fosfátu v životním prostředí (H 2 PO 4 - , HPO 4 2- , PO 4 3 )., Odvozeny od kyseliny fosforečné ztrátou jedním až třemi atomy d ‚vodík. Používají se v některých hnojivech , detergentech , jako inhibitory koroze nebo přísady do potravin (pak nesou čísla E338 až E343, pokud jsou ortofosfáty, E450 až E455, pokud jsou polyfosfáty). Jsou přítomny v přebytku ve vodě a jsou zdrojem eutrofizace (nebo dokonce dystrofizace ).
V organické chemii je fosfát typem organofosforové sloučeniny ; substitučními skupinami vodíků kyseliny fosforečné pak mohou být uhlíkové řetězce, někdy označované jako organický fosfát.
Dávkování
Měření koncentrace fosforečnanu je založeno na vzhledu komplexu fosforečnanu amonného amonného (en), který je detekován spektrofotometricky v ultrafialovém záření. Chloridové ionty mohou interferovat a měly by být odstraněny vařením se dvěma kapkami kyseliny dusičné ; přidání k molybdenickému činidlu vinanu zlepšuje specificitu.
Roztok z orthomolybdate amonného (NH 4 ) 2 MoO 4 ve směsi za horka s 6M kyselinou dusičnou a fosfátu, vznikne žlutá sraženina fosfomolybdenanu amonného (NH 4 ) 3 PO 4 (MoO 3 ) 2 .
Ionty stříbra pro fosfát dávají nažloutlé Ag 3 PO 4 sraženiny . Hydrogenfosforečnan sodný poskytuje s iontů Ag + žluté sraženiny fosforečnanu stříbra rozpustné v kyselině dusičné a amoniaku .
Protokol o dávkování byl ve Francii ověřen společností AFNOR .
Molekulární a chemické vlastnosti
Fosfátový iont (nebo orthofosforečnan ) je polyatomic anion s chemickým vzorcem P O 4 3 a molekulovou hmotností z 94.97 daltonů . Je ve tvaru čtyřstěnu , jehož vrcholy jsou tvořeny čtyřmi atomy z kyslíku rámců atom fosforu .
Tento iont, který má tři záporné náboje, je konjugovaná báze hydrogenfosforečnanového iontu HPO 4 2– (nebo anorganický fosfát , označovaný jako „ Pi “), který je sám o sobě konjugovanou bází dihydrogenfosforečnanového iontu H 2 PO 4 - který je sám o sobě konjugovaná báze kyseliny fosforečné H 3 PO 4 . Je to hypervalentní molekula s vědomím, že atom fosforu má na své valenční skořápce deset volných elektronů .
Fosfátová sůl se tvoří, když se kation váže na jeden z atomů kyslíku ve fosfátovém iontu a vytváří iontovou sloučeninu . Většina fosfátů je nerozpustná ve vodě za normálních teplotních a tlakových podmínek , s výjimkou solí alkalických kovů .
Rozpustný ve vodném roztoku , fosfát existuje ve svých čtyřech formách v závislosti na úrovni kyselosti . Přechod od nejzákladnějšího k nejkyselejšímu:
- první převládající formou je fosfátový ion (správný) PO 4 3– (silně bazický);
- druhou formou je hydrogenfosforečnanový ion HPO 4 2– (slabě bazický);
- Třetí způsob je dihydrogenfosforečnan iont H 2 PO 4 - (slabě bazický);
- čtvrtý je ve formě fosfátů trihydrogenfosfát (v neionizované krystalickém stavu), nebo kyseliny fosforečné H 3 PO 4 (silně kyselý v roztoku).
PK má předchozí páry kyselina / báze je:
- HPO 4 2– / PO 4 3– : 12,32;
- H 2 PO 4 - / HPO 4 2– : 7,09;
- H 3 PO 4 / H 2 PO 4 - : 2,15.
Fosfátový iont může tvořit polymerní ionty , například:
- difosfát P 2 O 7 4− (také nazývaný pyrofosfát );
- trifosfát P 3 O 10 5− .
Fosfáty tvořící komplexy s vápníkem (mikroenvironmentální kontrola během (bio) mineralizace), jsou často používány ve složení detergentů . Emise detergentů bohaté na fosfor proto zvyšují riziko eutrofizace . Od 80. let 20. století proto výrobci stále častěji používají náhražky, jako jsou zeolity .
Školení a expedice
Fosfát (skála koncentrovaných fosfátové soli) je sedimentární horniny s názvem hornina exogenní : je tvořen koncentrací, fosfátových iontů sraženiny ve skalní diageneze . Biogenní formy, jako jsou guanos ptáků a netopýrů, byly využívány po staletí.
Nejdůležitější ložiska jsou v Maroku , konkrétněji v Khouribga , v Severní Americe , na ostrově Navasse , v Tunisku , v Togu , v Izraeli , v Jordánsku , v Číně a na některých ostrovech Oceánie : Nauru , Banaba a Makatea a Senegal.
Průmyslová syntéza
Syntézu superfosfátů vyvinuli v průmyslovém měřítku podniky Kuhlmann, které již vyrábějí kyselinu sírovou, od 40. let 18. století, jako první, aby vyhověly potřebám pěstitelů řepy v oblasti Lille.
Fosfátové sloučeniny lze průmyslově syntetizovat. Například společnost Rhodia vyráběla ve Francii (v Rouenu) Tri-polyfosfát (TPP) ve výrobní jednotce, která byla nakonec uzavřena v rámci průmyslové restrukturalizace.
použití
Fosfáty se používají v zemědělství a zahradnictví jako hnojivo, které poskytuje rostlinám (ovoce, zelenině, ...) zdroj fosforu . Fosfátová hnojiva jsou zdaleka hlavním využitím fosfátů. Ruda , obvykle fosforečnany vápníku, mohou být aplikovány přímo na kyselých půdách po jemně mletý. Mít tendenci rekombinovat s vápníkem z půd, což ho činí méně asimilovatelným, musí být před použitím na vápenatých půdách více rozpustné ve vodě , což zahrnuje výrobu superfosfátů. V závislosti na původu rudy a jejím zpracování budou tato hnojiva pravděpodobně kromě vápníku a fosforu poskytovat také různé živiny. Tato hnojiva mohou být organického původu (kostní prášek, rybí kosti atd.) Nebo anorganická (napadení kyselinou na rudu), což je stále častěji, s výjimkou ekologického zemědělství, kde jsou syntetická hnojiva zakázána.
Jednoduchý superfosfát lze použít k čištění podestýlky v chovu zvířat. Přechází do hnoje a znovu hraje roli hnojiva.
Fosfát se také podílí na kvašení vína (typ ethylové fermentace ).
Dihydrogenfosfát H 2 PO 4 - vápníku nebo sodíku (E450) a hliník sodný kyselý fosfát (E541) se používají spojeny s hydrogenuhličitanem sodným jako kypřící prostředek na pečení. Byli mezi prvními chemickými kvasnicemi , nezanechali dochuť a do značné míry nahradili pekařské droždí .
Polyfosfáty se používají jako předúprava tvrdé pitné vody nebo jako předběžná nebo hlavní úprava pro změkčení vody obecně. Používají se značně jako složky detergentů .
Všechno živé obsahuje fosfáty: fosfátové skupiny jsou tedy prvky řetězce, které tvoří spirály DNA , adenosintrifosfát slouží jako nosič energie v buňkách, kosti a zuby jsou v zásadě tvořeny hydroxyapatitem (Ca 5 (PO 4 ) 3 ( ACH)) ...
Kyseliny fosforečné je obvykle získáván jako vedlejší produkt při výrobě superfosfát (napadení fosfátové rudy kyselinou sírovou).
Fosfát a jeho varianty Bonderizing a fosfátování jsou ocelí ošetření povrchové ochrany. Lázně s kyselinou fosforečnou se zde používají k výrobě povrchové vrstvy fosforečnanu železitého .
Ortofosforečnany (OP) přidané do pitné vody umožňují nanášet stabilní komplexy (např .: pyromorfit , Pb 5 (PO 4 ) 3 ) se železem, olovem nebo mědí v důsledku koroze kovových trubek. Tyto komplexy tvoří film, který snižuje kontakt mezi vodou (a jejím rozpuštěným kyslíkem) a toxickým kovem vnitřní stěny kovové trubky. Koroze je poté potlačena nebo zpomalena. Taková léčba je ve Velké Británii a USA povolena od 90. let a používá se v Kanadě a v poslední době v Irsku. V Belgii a České republice se používá k ochraně železných trubek.
Ve Francii : Veřejné přípojky a vnitřní olověné trubky musí být nahrazeny bezolovnatými trubkami, aby bylo možné bojovat proti otravě olovem a lépe dodržovat předpisy týkající se pitné vody (evropská směrnice 98/83 / ES týkající se kvality „vody určené pro lidskou spotřebu “ (EDCH). Limit kvality (LOQ) pro parametr olova (Pb) byl snížen z 50 na 25 μg / l v prosinci 2003, poté z 25 na 10 μg / l v prosinci 2013, v souladu s WHO doporučení Kromě těchto opatření, která vyžadují čas a za určitých podmínek, umožňuje kruhový film filmotvornou úpravu trubek přidáním kyseliny fosforečné nebo ortofosforečnanů (OP) do vody. To může omezit uvolňování olova z trubek, svarů a ventilové prvky (mosaz obsahuje olovo). Zatímco se tedy potrubí starých domů měnilo často pomalu, od roku 2003 do roku 2013 ve Francii deset výrobních závodů Funkce EDCH testovala léčbu pomocí OP (s prefekturním povolením).
V letech 2012 a 2013 požádalo Generální ředitelství pro zdraví (DGS), ministerstvo životního prostředí a CGDD Vysokou radu pro veřejné zdraví (HCSP), aby posoudila účinnost tohoto typu léčby a zaujala stanovisko. pokračovat v ní nebo ji zobecnit na jiné distribuční sítě (a pokud ano a za jakých podmínek ... s vědomím, že zastavení léčby by mohlo také vést k nevyváženosti mikrobiálních rovnováh biofilmů uložených na trubkách). Tento požadavek zpracovala pracovní skupina s názvem „ Zpracování EDCH ortofosforečnany “, jejíž závěry byly přijaty 4. července 2017. Kromě kyseliny fosforečné (NF EN 974) mohou být podle ANSES použitelné polyfosfáty. :
- dihydrogenfosforečnany sodné (NF EN 1198);
- fosforečnany trisodné (NF EN 1200);
- dihydrogenfosforečnany draselné (NF EN 1201);
- hydrogenfosforečnany draselné (NF EN 1202);
- fosforečnany draselné (NF EN 1203).
Ve Francii by dávka měla být 2 mg / l PO4 ³- kontinuálním vstřikováním do vody, zatímco se vytvoří ochranná vrstva (až 6 měsíců), poté 1 mg / l PO4 ³- ( tj. 0,3 mg / l Fosfor). Jinde se sazby liší (v závislosti na zemi) od přibližně 0,5 do 6 mg / l PO4 ³- .
Zpětná vazba : vykazují určité snížení uvolnění, ale ne jeho úplné vyloučení; v případě studovaném ve Francii bylo 1 mg / l v PO4 ³- dostatečné ke snížení obsahu olova v roztoku o 60% „aniž by však byla systematicky respektována LOQ 10 μg / l na kohoutku kvůli specifickým vlastnostem určitých konstrukcí“ ; účinek se velmi liší v závislosti na koncentraci olova a kvalitě vody (pH, tvrdost a TAC a možná přítomnost galvanických párů olovo-měď atd.). V únoru 2007 agentura AFSSA poznamenala, „že provádění úprav fosfátováním vodou je pouze přechodným krokem ke snížení obsahu olova ve vodovodní vodě spotřebitele pod 25 μg / l, ale nelze ji prodloužit po roce 2013, kdy je limit 10 μg / L lze respektovat pouze výměnou těchto olověných potrubí ve veřejných a soukromých sítích “ .
Dopady na životní prostředí spojené se zemědělstvím
Obecnější stránky: Půdní ekologie a historie zemědělství # Pokroky v agronomii, kontrola hnojení a mechanizace v 19. století
Fosfátová hnojiva používaná v zemědělství
Používání hnojiv je jedním ze základů moderní zemědělské výroby. Spolu s rozvojem průmyslové výroby superfosfátů (Kuhlmann Establishments) vysvětluje a popularizuje základy používání hnojiv německý chemik Justus von Liebig ve své knize: Organická chemie aplikovaná na fyziologii rostlin a zemědělství , která je předmětem mnoha reissues od 1840 až 1865.
Konkrétní problémy týkající se používání fosforu (většina fosforu v půdě se nachází v nerozpustné formě blokované minerálními nebo organickými látkami) a zvláštnosti jeho asimilace však zdůrazňují agronomové a zemědělci (zejména odborníci v ekologickém zemědělství). Budou postupně objasňovány prací na struktuře půdy a interakcích rostlin a mikroorganismů. Tyto interakce jsou dodnes předmětem výzkumu.
Přírodní minerální fosfáty ( guano nebo fosfáty sedimentárního původu ) se široce používají, zejména v kyselých půdách, kde je fosfor jednou z omezujících živin pro rostliny, ale snadno se mobilizuje. Minette (železná ruda) také obsahuje apatit; Thomas proces dal možné získat kvalitní ocel a obnovit ko-produkt, Thomas strusky , obsahující křemičitofosforečnany vápenaté a fosforečnany (12 až 18% P 2 O 5 ) a další prvky (hořčík, oxidy kovů). Bylo to nejpoužívanější fosfátové hnojivo ve Francii (40% spotřeby v roce 1966). Minette nebyla využívána od roku 1997.
V půdách s neutrálním nebo zásaditým pH se místo toho používají snáze asimilované superfosfáty . Jedná se o přírodní fosfáty ošetřené kyselinou fosforečnou, kyselinou sírovou, amoniakem podle:
- trojitý Super fosfát nebo Triple Super fosfát (TSP), zejména Ca (H 2 PO 4 ) 2 , testování 45% P 2 O 5 je vyroben s fosfátu a kyseliny fosforečné.
- jednoduchý superfosfát nebo Single Super fosfát (SSP), obecného vzorce Ca (H 2 PO 4 ) 2 , testování 18% P 2 O 5 s různým poměrem kyseliny fosforečné CaSO 4 , 2 H 2 O schopen poskytnout síru . se s kyselinou fosfátu sírovou a voda.
- neobvyklý dvojitý superfosfátový meziprodukt mezi dalšími dvěma vzorci
- amoniový superfosfátů: hydrogenfosforečnan amonný ( DAP ), (NH 4 ) 2 HPO 4 a dihydrogenfosforečnanu amonného ( MAP ), NH 4 H 2 PO 4 , v suché nebo kapalné formě, atd. které poskytují dusík. DAP se vyrábí s amoniakem a kyselinou fosforečnou, amoniak poskytuje dusík a kyselina fosforečná poskytuje fosfor.
Tato hnojiva se používají samostatně nebo častěji v kombinaci s dusíkem a draslíkem ( NPK )
Důsledky
Fosfátové hnojení je považováno za nezbytné pro současné zemědělství. Přírodní fosfáty a jednoduché superfosfáty zdaleka nejsou čistými produkty a mohou obsahovat jiné prvky než fosfor, jejichž přítomnost může nebo nemusí být žádoucí. Přítomnost vápníku, hořčíku, síry a stopových prvků (zinek, mangan ...) je obecně považována za prospěšnou.
Pokud jsou fosforečnany běžně přítomny a užitečné v nízkých dávkách ve vodě a v půdě , je jejich přebytek (spolu s přebytkem obsahu dusičnanů ) jednou z hlavních příčin eutrofizace nebo dokonce dystrofizace prostředí. Horizontální nebo vertikální přenosy fosforečnanů do povrchových vod se velmi liší (od 0,1 do 2,5 kg ha −1 rok −1 ), v závislosti na typu půdy, jejím pH , obsahu humusu a jeho použití (orba, trvalá louka atd.) ). V průměru je 9% fosforu (z čehož polovinu tvoří hnojiva) odváděno odtokem.
Přispívají zejména k problémům zákalu spojeným se ekologizací vod (včetně květů planktonu ) a s jevy mrtvých mořských zón pod ústí řek .
Jsou také zdrojem „ těžkých kovů “, které jsou pro některé možná radioaktivní , protože fosfor minerálního původu je často v hnojivech spojen s toxickými kovy ( kadmium (až 87 mg · kg -1 ve fosfalu produkovaném v Senegalu) , chrom (Cr), rtuť (Hg) a olovo (Pb) a radioaktivní prvky, včetně uranu (U). Některá fosfátová hnojiva obsahují významná množství uranu , tedy radia a vedou k větší emanci radonového plynu , . úrovně dosáhnout až 390 mg · kg -1 v tanzanských dolech z Minjingu proti 12 mg · kg -1 v tuniské uložení z Gafsa , nyní Minjingu fosfát je agronomicky velmi účinný a levný, a proto široce používaný na obdělávaných kyselých půdách, což klade toxikologické a zdravotní otázky týkající se důlních pracovníků a ekotoxikologické týkající se odpadní horniny (včetně radioaktivní fosfosádrové strusky ). Uran z fosfátů se někdy získává a představuje přibližně 5% světové produkce uranu v roce 2010 ( těžba uranu ).
Kadmium, jehož prvním zdrojem v terénu je často fosfátové hnojivo, může představovat vážné problémy a je zvláště biologicky asimilovatelné v případě ve vodě rozpustných fosfátových hnojiv, zatímco vzhledem k tomu, že je spojeno s apatitem , je méně rozpustné. ve vodě nerozpustná hnojiva. Je ještě více biologicky asimilovatelný v kyselých půdách a / nebo v přítomnosti nedostatku některých dalších stopových prvků ( železo atd.).
Minerální fosfátová hnojiva jsou také velmi bohatá na fluor (z apatitu, který obsahují). Fluorid často přesahuje 3% z celkové hmotnosti. Tento fluorid může u zvířat, která se pasou na ošetřené půdě, způsobit fluorózu , pravděpodobně ne proto, že tento fluor absorbují v rostlinách (které se málo koncentrují), ale proto, že přijímají půdu obohacenou o fluorid s jídlem nebo olizováním.
Úprava apatitu kyselinou fosforečnou za účelem výroby trojitých superfosfátů však vede k následující reakci:
Ca 5 (PO 4 ) 3 F + 7 H 3 PO 4 → 5 Ca (H 2 PO 4 ) 2 + HF, HF reaguje s oxidem křemičitým rudy za vzniku H 2 SiF 6 používaného v metalurgii hliníku , což z něj dělá je možné odečíst fluor z hnojiva.
V plodinách je fosfor normálně přijímán rostlinami prostřednictvím mykorhiz . Tato trasa se týká většiny rodin s výraznou výjimkou kříže a chenopodiaceae . Nadměrné příspěvky fosfátových hnojiv však vedou rostliny k tomu, že se neobejdou bez mykorhiz, které se vyvíjejí jen málo, což činí tuto klíčovou fázi cyklu fosforu nefunkční . Pěstované rostliny již nemohou tento mechanismus využívat a nemohou již asimilovat fosfor jinak, než prostřednictvím nových masivních vstupů fosfátů. Fosfor v přebytečných hnojivech, vyluhovaný deštěmi, se může hromadit v sedimentech rybníků, kde zůstává k dispozici déle než dusičnany (víceméně v závislosti na koncentraci sedimentu v železa ve formě oxyhydroxidu železitého FeO (OH) a v závislosti na pH tohoto sedimentu.
Ve Francii bylo podle zprávy zveřejněné v roce 2009 o fosforečnanech v půdách metropolitní Francie v roce 2001 dovezeno na francouzské půdy 775 000 tun ve formě minerálních hnojiv. O šest let později (v roce 2007) z 2 372 měřicích bodů téměř polovina půd analyzovaných ve Francii stále představuje problém: 2% jsou nekvalitní, 4% průměrné, 12% průměrné, 55% dobré a 27% velmi dobré.
Minerální hnojiva zůstávají hlavním zdrojem ztráty fosforu ve vodě (50%) ve Francii, před živočišným odpadem (přímo nebo častěji rozmetáním hnoje a kejdy ) (40%). Následuje domácí městské odpadní vody (kolem 5%) a průmyslové (2%) a čistírenské kaly (2%).
Ve Francii a v dalších evropských zemích zemědělci nakupovali celkově méně minerálních fosfátových hnojiv (o dvě třetiny méně od roku 1972 do roku 2008 ), ale tento pokles se týká hlavně oblastí zanedbávání zemědělství nebo ekologického zemědělství; analýzy ukazují, že obsah fosforu v některých zemědělských půdách se silně zvýšil (+ 43% studovaných kantonů, zejména v Bretani , Pays de la Loire , Champagne-Ardenne a Aquitaine ). S rozvojem čistíren odpadních vod a nadzemním šlechtením se množství kalů a hnoje nebo kejdy prudce zvýšilo od 70. let 20. Tento kal se šíří nejčastěji, jako trus chovu drůbeže na zemědělských půdách.
Možný vývoj
Viz také Mycorrhiza # Applications
Ve Francii mohou agroenvironmentální opatření, jako je „ trvalá ochrana životního prostředí “ nebo „ travní pásy “, pomoci zachytit část fosfátů stékajících z polí, aby nebyly odplaveny vodními cestami. Tyto přírodní laguny mohou také přispět k lepší léčbě dusičnanů a fosforu, případně terciární ošetření po proudu z čistírny odpadních vod „klasické“.
S ohledem na znalosti získané od roku 1990 v půdních organismech, zejména v oblasti mykorhiz, se zdá nový přístup k hnojení fosfáty možný. Propagací vývoje mykorhiz a možným naočkováním , což je již osvědčená technika, by bylo možné drasticky snížit hladinu fosfátového hnojení. Biologové jako Marc-André Selosse navrhují studovat přesně tímto způsobem.
Recyklace
Zpětné získávání fosforečnanů obsažených v odpadní vodě umožňuje omezit eutrofizaci vodních toků a představuje další zdroj fosfátů. Tato činnost, která je stále nedostatečně rozvinutá, je předmětem mnoha výzkumů. Nejběžnější léčba spočívá ve vysrážení fosforu; drahé, mohlo by to být nakonec nahrazeno nebo kombinováno s biologickým ošetřením.
Pro lidské výkaly jsou biologicky řízené toalety podestýlky alternativou: snadno použitelné a levné, obcházejí problém čištění vody a umožňují vyrábět levný kompost.
Legislativa
Vzhledem k tomu, 1 st července 2007, fosfáty jsou zakázány v pracích prostředcích ve Francii. Díky použití dalších aktivních molekul se zlepšila kvalita vody mnoha jezer znečištěných městskou vodou. Zemědělství se nyní stalo primárním zdrojem znečištění fosfáty. V Belgii a Švýcarsku jsou fosfáty v detergentech již několik let zakázány.
Výroba a rezervy
The Chinese , tím Maroko a Spojené státy jsou tři hlavní země fosfát producentů, které tvoří více než 70% světové produkce. Maroko tvoří více než tři čtvrtiny světových potvrzených zásob, velká část jeho rezervy mimo Západní Sahary . Fosfor je omezený zdroj, který za současných podmínek používání nakonec zažije vrchol svého využívání .
| Země | Výroba (kt) |
Světový podíl (%) |
Rezervy (kt) |
|---|---|---|---|
| Jižní Afrika | 1700 | 0,65 | 1,5 miliónu |
| Alžírsko | 1 500 | 0,57 | 2 200 000 |
| Austrálie | 2 500 | 0,96 | 1 100 000 |
| Brazílie | 6500 | 2.49 | 320 000 |
| Čína | 138 000 | 52,87 | 3 100 000 |
| Egypt | 5 500 | 2.11 | 1 200 000 |
| Spojené státy | 27 800 | 10,65 | 1 100 000 |
| Indie | 1 500 | 0,57 | 65 000 |
| Izrael | 3 500 | 1.34 | 130 000 |
| Jordán | 8 300 | 3.18 | 1 300 000 |
| Kazachstán | 1 800 | 0,69 | 260 000 |
| Mexiko | 1700 | 0,65 | 30 000 |
| Maroko a Západní Sahara | 30 000 | 11,49 | 50 000 000 |
| Peru | 4000 | 1.53 | 820 000 |
| Rusko | 11 600 | 4.44 | 1 300 000 |
| Saudská arábie | 4000 | 1.53 | 680 000 |
| Senegal | 1250 | 0,48 | 50 000 |
| Sýrie | - | 0,34 | 1 800 000 |
| Jít | 900 | 0,34 | 30 000 |
| Tunisko | 3 500 | 1.34 | 100 000 |
| Vietnam | 2800 | 1,07 | 30 000 |
| Ostatní země | 2410 | 0,92 | 810 000 |
| Celkový | 261 000 | 100 | 68 000 000 |
Obchod
Francie je dovozcem fosfátů.
| Země | Hodnota v tisících eur |
Dovezená prostornost |
|---|---|---|
| Litva | 52,433 | 150 486 |
| Rusko | 35 574 | 105 884 |
| Maroko | 33,449 | 103 333 |
| Tunisko | 18 220 | 48,080 |
| Belgie | 5 399 | 11 877 |
| Mexiko | 3 391 | 8 999 |
| Německo | 1645 | 4241 |
| Ostatní země | 4 286 | 11 479 |
Poznámky a odkazy
- vypočtená molekulová hmotnost od „ atomové hmotnosti prvků 2007 “ na www.chem.qmul.ac.uk .
- Biogeochemický a ekologický cyklus fosforu byl změněn člověkem, který jej nedávno masivně zavedl ve formě hnojiva ( eutrofizace ) v agrosystémech a nepřímo v ekosystémech ( Atlas světa oceánů ).
- AFNOR, 1990, Stanovení ortofosforečnanů, fosforečnanů a celkového fosforu . In: AFNOR (Éd.), Waters Test methods , Paris, str. 87–97.
- Harvey Lodish, Arnold Berk, Paul Matsudaira, James Darnell , Chris A. Kaiser, Pierre L. Masson, Molekulární biologie buňky , str. 301
- Kumler, WD; Eiler, JJ, J. Am. Chem. Soc. 1943, 65, 2355.
- https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Product_Information_Sheet/1/p6560pis.pdf
- Aftalion, Fred. , Historie mezinárodního chemického průmyslu , chemického dědictví Press,2001( ISBN 0941901297 a 9780941901291 , OCLC 47764354 , číst online )
- Úřední věstník (2007) Bulletin povinných právních oznámení bulletin č. 40 Rhodia SA Společnost s ručením omezeným s kapitálem 1 204 186 174 EUR. Sídlo společnosti: Budova Coeur Défense, Tour A, 110, promenáda Charles-de-Gaulle, 92400 Courbevoie. 352 170 161 RCS Nanterre JO ze dne 2. dubna 2007
- „Fosfátová hnojiva“ , na agroneo.com
- Stav životního prostředí, „ Reference červen 2010 “ ( Archiv • Wikiwix • Archive.is • Google • Co dělat? ) , Životní prostředí ve Francii, Obecná komise pro udržitelný rozvoj • Pozorovací a statistická služba ( str. 41-42 / 152)
- ANSES (2017) Dopady úpravy vody určené k lidské spotřebě ortofosforečnany s cílem omezit rozpouštění olova ; Říjen 2017, vědecké vydání; Zpráva podepsaná 3. 10. 2017; Stanovisko ANSES Doporučení č. 2015-SA-0094 (Související doporučení č. 2001-SA-0218, 2003- A-0042, 2003-SA-0096, 2003-SA-0314, 2003-SA-0378), PDF, 194p
- Stanovisko Afssy ze dne 27. března 2002 týkající se studijního programu navrženého Société Anonyme de Gestion des Eaux de la Ville de Paris (SAGEP) v rámci implementace kyselé ortofosforečné EDCH.
- Stanovisko Afssa ze dne 10. prosince 2003 týkající se monitorování provádění úpravy ortofosforečnany distribuční vody v pařížském regionu s cílem snížit koncentraci Pb v TUV, revidované stanoviskem ze dne 15. února 2007
- Stanovisko Francouzské agentury pro bezpečnost potravin týkající se ošetření EDCH kyselinou ortofosforečnou produkovanou rostlinami Choisy - le - Roi, Méry - sur - Oise a Neuilly - sur - Marne.
- Dominique Soltner, Základy rostlinné výroby , Angers, Zemědělské vědy a techniky,1985, str. 391
- Davet, Pierre. „ Mikrobiální život půdy a rostlinné výroby , Národní institut agronomického výzkumu,1996( ISBN 2738006485 a 9782738006486 , OCLC 413778130 , číst online ) , s. 160
- Marc-André Selosse, „ Mycorhyze, symbióza, která učinila život na zemi “, Pour la Science ,prosince 2018, str. 67-73 ( ISSN 0153-4092 )
- Publikace „Fosfor v půdách, agronomická nutnost, ochrana životního prostředí“ , červen 2009, Pozorovací a statistická služba (SOeS) Generální komise pro udržitelný rozvoj, sb. „Bod na“
- Podle Van Kauwenbergha, 1997, citovaného FAO ( tabulka 27; Chemická analýza potenciálně nebezpečných prvků v sedimentárních přírodních fosfátech )
- (in) Ama, B. Swinkels, A. a Buresh, RJ, „ Agronomická a ekonomická hodnocení organického a anorganického fosforu v západní Keni “ , Agron. J. , n o 89, 1997, str. 597-604.
- Weil, RR (2000), Vliv půdy a rostlin na reakci plodiny na dvě africké fosfátové horniny , Agron. J. , 92: 1167-1175.
- Sophie Gabriel, „ Uran z fosfátů: omezenější zdroj, než se obvykle očekávalo “ , La Lettre de l'Itésé ,podzim 2011(zpřístupněno 15. prosince 2018 )
- Iretskaya et al. (1998), citovaný FAO v Sekundární živiny, stopové prvky, účinek vápnění a nebezpečné prvky spojené s používáním přírodních fosfátů ( kapitola 8 dokumentu „Užití přírodních fosfátů pro udržitelné zemědělství“)
- McLaughlin, MJ, Simpson, P., Fleming, F., Stevens, DP, Cozens, G. a Smart, MK (1997), Vliv typu hnojiva na koncentrace kadmia a fluoru v jetelovém bylině , Aus. J. Exp. Ag. , 37: 1019-1026.
- Claude a Lydia Bourguignon, Půda, Země a pole , str. 81-82
- Golterman HL a De Groot CJ, 1994, Nové znalosti forem fosfátů: Důsledky pro fosfátový cyklus v mělkých sladkovodních sedimentech , Ann. Limnol. , 30 (3), s. 221-232 ( shrnutí )
- Disertační práce Marie-Soleil Beauregard, Dopady hnojení fosfáty na mikrobiální biodiverzitu zemědělských půd , University of Montreal, 05.05.2010
- Fortin, J. André. a Piché, Yves. „ Mycorrhizae: vzestup nové zelené revoluce , Editions Quae, dl 2016, policajt. 2016 ( ISBN 9782759224333 a 2759224333 , OCLC 936688556 , číst online )
- Jack Testard, Recycler des fosfáty , pour la Science , n o 387, leden 2010, str. 38
- „Francie zakazuje fosfáty v detergentech“ , 2. dubna 2007, na aqueduc.info
- (in) „ Phosphate Rock “ [PDF] na minerálech.usgs.gov (přístup 24. března 2017 )
- „ Ukazatel dovozu / vývozu “ , Generální ředitelství cel. Uveďte NC8 = 31053000 (zpřístupněno 7. srpna 2015 )
- (fr) Tento článek je částečně nebo zcela převzat z článku Wikipedie v angličtině s názvem „ Fosfát “ ( viz seznam autorů ) .
Podívejte se také
Související články
Bibliografie
- Využití fosfátové horniny pro udržitelné zemědělství , Bulletin FAO, Hnojiva a výživa rostlin / Technické vydání , společná publikace divize rozvoje půdy a vody FAO a Mezinárodní agentury pro atomovou energii , Řím, 2004.
- (en) Karl-Erich Schmittner a Pierre Giresse , „ Mikroenvironmentální kontroly biomineralizace: povrchové procesy srážení apatitu a kalcitu v kvartérních půdách, Roussillon, Francie “ , Sedimentology , sv. 46, n o 3,1999, str. 463-476.
- (en) Heald, PJ (1956), Účinky elektrických pulsů na distribuci radioaktivního fosfátu v mozkových tkáních , Biochemical Journal , 63 (2), 242.
- Paul Hubert, Praktické pojednání o obohacení fosfátů , Paříž, Baudry, kol. " Průmyslový institut severu ",1896, In-8 °, III-165 s. p. (oznámení BNF n o FRBNF30622902 )
externí odkazy
- Zelené řasy způsobené fosforečnany ze zemědělství , na drainageagricole.canalblog.com .
