Bromometan
| Bromometan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Synonyma |
Methylbromid |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne o ECHA | 100 000 740 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne o EC | 200-813-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 6323 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 39275 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ÚSMĚVY |
CBr , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / CH3Br / c1-2 / h1H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | zkapalněný, bezbarvý stlačený plyn bez zápachu. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemické vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hrubý vzorec |
C H 3 Br [izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární hmotnost | 94,939 ± 0,002 g / mol C 12,65%, H 3,19%, Br 84,16%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolární moment | 1,8203 ± 0,0004 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzikální vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T. fúze | -93,66 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° vroucí | 3,56 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpustnost | ve vodě při 20 ° C : 1,5 ml / 100 ml | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametr rozpustnosti δ | 19,6 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
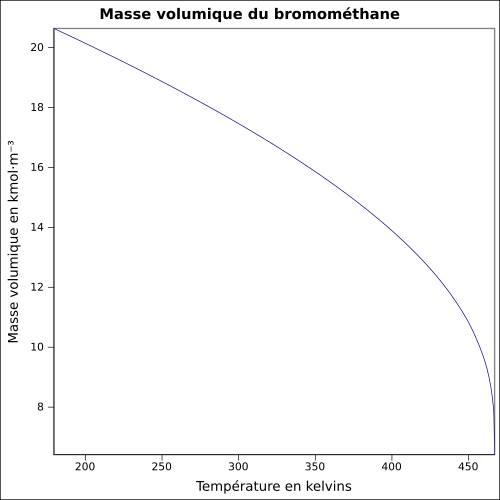
| Objemová hmotnost |
3,9739 g · cm -3 ( 0 ° C , 1013 mbar )
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota samovznícení | 537 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bod vzplanutí | < 194 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Meze výbušnosti ve vzduchu | 8,6 - 20 % obj | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
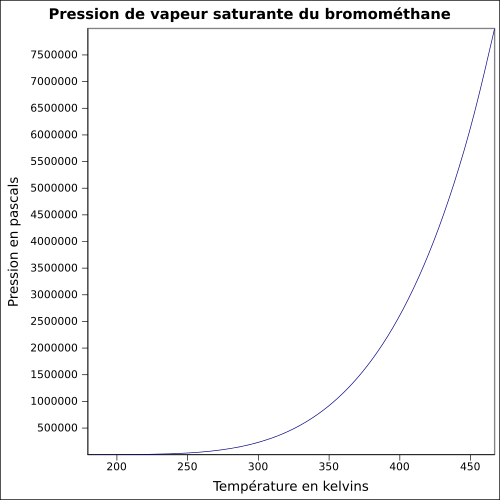
| Tlak nasycených par |
1,89 bar při 20 ° C 2,6 bar při 30 ° C 4,9 bar při 50 ° C rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritický bod | ( 194 ° C ), 52,3 bar , 0,577 kg · l -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trojitý bod | ( -93,7 ° C ), 0,002 baru | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 kapalina, 1 bar | 155,14 J · K -1 · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 plyn | -34,3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 kapalina | -60,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ fus H ° | 6,0 kJ · mol -1 až -93,65 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° | 23,24 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
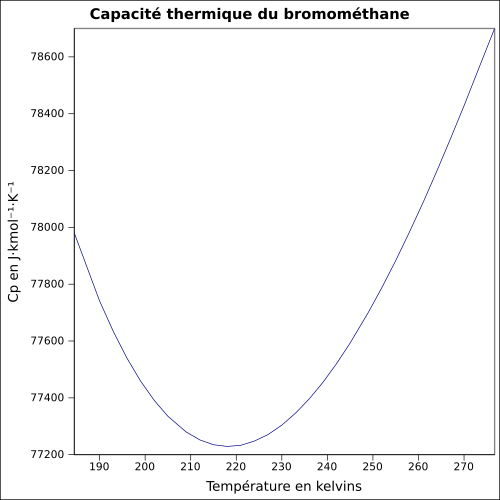
| C str |
114,6 J · K -1 · mol -1 (kapalina, 9,85 ° C )
rovnice:
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronické vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ionizační energie | 10 541 ± 0,003 eV (plyn) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opatření | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
    Nebezpečí H301, H315, H319, H331, H335, H341, H373, H400, EUH059, H301 : Toxický při požití H315 : Způsobuje podráždění kůže H319 : Způsobuje podráždění vážné očí H331 : Toxický při vdechování H335 : Může dráždit dýchací soustavy H341 : Podezření na genetické poškození (uveďte cestu expozice, je-li přesvědčivě prokázáno, že žádná jiná cesta expozice způsobuje stejné nebezpečí) H373 : Podezření na riziko vážného poškození orgánů ( uveďte všechny postižené orgány, jsou-li známy) v důsledku expozice opakovaná nebo dlouhodobá expozice (uveďte cestu expozice, je-li přesvědčivě prokázáno, že žádná jiná cesta expozice nezpůsobuje stejné nebezpečí) H400 : Vysoce toxický pro vodní organismy EUH059 : Nebezpečný pro vrstvu ozonu |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, D1A, D2B, E, A : Absolutní tlak par stlačeného plynu při 50 ° C = 480 kPa D1A : Vysoce toxický materiál s vážnými okamžitými účinky Přeprava nebezpečných věcí: třída 2.3 D2B : Toxický materiál s jinými toxickými účinky Chronická toxicita E : Žíravý materiál nekróza lidské kůže Zveřejnění na 1,0% podle klasifikačních kritérií |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Doprava | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
26 : jedovatý plyn UN číslo : 1062 : METHYL BROMIDE Třída: 2.3 Štítek: 2.3 : Toxické plyny (odpovídá skupinám označeným velkým T, tj. T, TF, TC, TO, TFC a Bam). Balení: -  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klasifikace IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina 3: Nezařaditelné z hlediska jeho karcinogenity pro člověka | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Požití | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| jiný | deprese z centrálního nervového systému . Poškození jater a ledvin . Zástava dechu. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoxikologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1.19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prahová hodnota zápachu | nízká: 20 ppm vysoká: 1000 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednotky SI a STP, pokud není uvedeno jinak. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Methylbromid nebo methylbromid je organická chemická sloučenina halogenované , jehož chemický vzorec je: C H 3 Br . Je součástí methylesteru halogenidů ( halogenované uhlovodíky ):
Je to jedovatý a vysoce ekotoxický plyn , bezbarvý a nehořlavý bez výrazného zápachu. Jeho chemické vlastnosti jsou docela podobné jako u chlormethanu .
Je to pesticid ( insekticid ) z rodiny biocidů . Je součástí chladicích plynů. Methanbromid se prodává pod různými názvy, z nichž nejznámější jsou Embafume a Terabol . Je také známý pod názvem R40B1 .
Jelikož se jedná o skleníkový plyn (silný) a jeden z plynů, které ničí ozonovou vrstvu, která chrání Zemi před nadměrným ultrafialovým zářením , plánuje se dlouhodobý zákaz, ale tento zákaz uplatňují pouze některé země, Francie od roku 2005 (s výjimky pro určitá použití) a Evropská unie od roku 2011.
Na třicátém zasedání smluvních stran Montrealského protokolu o látkách, které poškozují ozonovou vrstvu, které se konalo v Quitu , hlavním městě Ekvádoru, Kanady , Austrálie , Argentiny a Jižní Afriky, byly rovněž získány výjimky pro používání methylbromidu na roky 2019 a 2020
Původ
Methanbromid existuje v přírodě v malém množství, kde se přirozeně tvoří v oceánu a syntetizuje ho fytoplankton (a řasa ?).
Je-li biogenní (přírodního původu, produkovaný živými organismy), hraje v přírodě dosud neznámou roli. Možná by mohl být zapojen do zpětné vazby o podnebí (protože pokud je jeho doba pobytu v atmosféře krátká (asi 1 rok), jedná se o silný skleníkový plyn a inhibuje produkci stratosférického ozonu .
Během nedávné geoinženýrské experimentu , jehož cílem je zvýšení kapacity mořských propadů uhlíku tím, hnojení na oceán s železem na stupnici od média (plochou povrchu menší než 1000 km 2 ), nepříznivý účinek byl pozorován: zvýšená produkce oceánské brommethan.
Pochází také z některých suchozemských rostlin, zejména z čeledi brassica .
Průmyslově se jako biocid vyrábí reakcí methanolu s kyselinou bromovodíkovou .
Použití
Dokud jeho výroba a použití nebyly omezeny nebo zakázány Montrealským protokolem (podepsaný v roce 1987, ale stále neúplně respektován), byl široce a široce používán jako prostředek pro sterilizaci půdy, hlavně pro produkci semen, ale také pro některé rostlinné plodiny, jako jsou jahody .
Methanbromid se také používá jako fumigant pro všeobecné použití k hubení nejrůznějších škůdců, od krys a hmyzu až po mikroskopické houby. Stále se používá pro určitá použití (dezinfekce dováženého dřeva). To také slouží jako prekurzor pro výrobu jiných chemických látek, a to byl použit jako rozpouštědlo pro extrakci z olejů ze semen a jako odmašťovací z vlny .
Když Montrealský protokol přísně omezil použití methylbromidu na mezinárodní úrovni, některé země, včetně Spojených států, podpořily výjimky pro použití produktu v kontrolovaném použití. V roce 2004, posledním roce, za který jsou k dispozici údaje, bylo v kalifornských polích nastříkáno více než 3 000 tun methylbromidu.
V roce 2017 bylo na karanténu a před odesláním použito téměř 10 000 tun methylbromidu a toto číslo rostlo. Za poslední desetiletí se množství methylbromidu použitého pro karanténní a předzásilkové ošetření v některých zemích více než zdvojnásobilo, pravděpodobně kvůli zvýšenému obchodu, nebezpečí, která představují karanténní škůdci, a / nebo nesprávné klasifikaci určitých použití jako karantény a použití zásilky. Ty byly hlavní složkou globálních emisí, které činily přibližně 7 500 tun ročně. Methylbromid použitý pro karanténu a před odesláním byl vysoce těkavý (až 95% takto použitého methylbromidu bylo možné po fumigaci uvolnit přímo do atmosféry). Pokroky v technikách využití a zničení by však mohly výrazně snížit emise.
Methanbromid se kdysi používal ve speciálních hasicích přístrojích před příchodem méně toxických halonů , protože je elektricky nevodivý a nezanechává žádné zbytky. Používal se hlavně pro elektrické rozvodny, vojenská letadla a proti určitým průmyslovým rizikům. Nikdy nebyl tak populární jako ostatní agenti kvůli jeho vysoké ceně a toxicitě. Methanbromid se používal od 20. do 60. let. Ve Francii vyhláška č. 59-449 z21. března 1959zakázáno z 1. st leden z roku 1961, výroba, držení, plnění, převod za úplatu nebo zdarma hasicí přístroje naplněné methylbromidem nebo tetrachlormethanem .
Zničení ozonové vrstvy
Methanbromid je na seznamu látek zakázaných Montrealským protokolem z důvodu rizika zničení ozonové vrstvy . Jelikož je brom 60krát škodlivější než chlór , stačí i malé množství methylbromidu , aby značně poškodilo ozonovou vrstvu . V letech 2005 a 2006 jí však byla podle Montrealského protokolu udělena výjimka pro kontrolované používání.
Kontroverze
Montrealský protokol stanoví, že použití brommethan musí být zakázána, ale tento produkt měl mnoho výhod, a to zejména pro léčbu dřeva, zeminy, obilí a semena, a pro některé účely, nejsou k dispozici žádné náhradní produkty. K dispozici za stejnou cenu, nebo jak pohodlné. Methanbromid se ve Spojených státech používá k přípravě golfových hřišť a povrchů trávníků používaných pro různé atletické soutěže, zejména k údržbě daktylonských trávníků Cynodon . Vláda George W. Bushe přijala výjimky, aby zabránila narušení trhu.
V roce 2010 EFSA aktualizoval posouzení rizik
Zdravé efekty
Při krátkodobém vdechování ve vysoké koncentraci způsobuje bolesti hlavy, závratě, nevolnost, zvracení, malátnost. Po těchto příznacích mohou následovat známky nervového vzrušení, křeče nebo dokonce akutní duševní poruchy, jako je manická agitovanost . Dlouhodobé vdechování při nižších koncentracích může způsobit podráždění průdušek a poškození plic.
Kapalina spaluje pokožku, způsobuje svědění a erytém, poté několik hodin po kontaktu puchýře. Kapalina a plyn způsobují těžké poleptání očí.
Úrovně expozice, které mohou způsobit smrt, se pohybují od 1 600 do 60 000 ppm , v závislosti na délce expozice.
Respirační, renální a neurologické poškození postihuje více lidí. Po expozici nízkým hladinám u lidí nebyly zaznamenány žádné závažné dlouhodobé účinky na nervový systém , ale studie na králících a opicích prokázaly léze klasifikované jako středně závažné až závažné.
Výroba a degradace
Zdroje produkce CH 3 Br zahrnují produkci oceánů, emise z rostlin a močálů , spalování biomasy , fumigaci půdy a výfukové plyny z olovnatého paliva a také průmysl. Výroba trvanlivého spotřebního zboží a zboží podléhajícího rychlé zkáze. Jeho průmyslová výroba klesá, ale nebyla zastavena, a to ani ve Francii
Degradace znečišťující látky dochází fotochemického rozkladu v atmosféře (reakce s chemickým radikály hydroxyl (OH)) a oxidací (který dává jako vedlejší produkty BRC (O) CH 3 a BRC (O) H), nebo photodecomposition na vyšší nadmořské výšky.
K těmto prostředkům eliminace je třeba přidat ztráty (adsorpce, degradace) v půdách, chemická a biologická degradace v oceánu a určitá recyklace zelenými rostlinami.
Alternativy
Pro mnoho použití (např. Ošetření dřeva, fumigace půdy před výsadbou) neexistuje alternativa tak snadno implementovatelná (nebo jinak, s větším toxickým rizikem, pokud se jako alternativa použije například chloropikrin používaný během světové války Já jako válečný plyn a jako plyn k zabíjení zvířat v jejich norách, nebo dazomet ...)
- Tepelné ošetření lze použít k dezinfekci skleníkových podlah (kromě oken) nebo kurníku (v případě potřeby se stejným vybavením jako pro termální odplevelení )
- Integrovaná ochrana proti škůdcům; například podle ANSES se může zemědělec sdružovat v zemědělství
- pečlivé prozkoumání rozmnožovacích grafů,
- pěstování odrůd s vysokou úrovní odolnosti,
- produkce semen na nepoškozených pozemcích,
- odběr vzorků a analýza dávek osiva,
- odstranění rostlinných zbytků spojených se semeny,
- kulturní praktiky, které omezují riziko propuknutí patogenu (rotace atd.).
Poznámky a odkazy
- METHYL BROMIDE , bezpečnostní listy Mezinárodního programu pro chemickou bezpečnost , konzultovány 9. května 2009
- (in) David R. Lide, Příručka chemie a fyziky , Boca Raton, CRC,16. června 2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 a 1-4200-6679-X ) , s. 9-50
- vypočtená molekulová hmotnost od „ atomové hmotnosti prvků 2007 “ na www.chem.qmul.ac.uk .
- Záznam „Bromomethane“ v chemické databázi GESTIS IFA (německý orgán odpovědný za bezpečnost a ochranu zdraví při práci) ( německy , anglicky ), přístup ke dni 19. února 2009 (je vyžadován JavaScript)
- (in) James E. Mark, Fyzikální vlastnosti příručky pro polymery , Springer,2007, 2 nd ed. , 1076 str. ( ISBN 978-0-387-69002-5 a 0-387-69002-6 , online prezentace ) , s. 294
- (en) Robert H. Perry a Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , str. 2-50
- (en) „Methylbromid“ , na NIST / WebBook , přístup
- (in) Carl L. Yaws, Handbook of Thermodynamic Diagrams , sv. 1, 2 a 3, Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 , 0-88415-858-6 a 0-88415-859-4 )
- (in) David R. Lide, Příručka chemie a fyziky , Boca Raton, CRC,2008, 89 th ed. , 2736 str. ( ISBN 978-1-4200-6679-1 ) , str. 10-205
- Pracovní skupina IARC pro hodnocení karcinogenních rizik pro člověka, „ Globální hodnocení karcinogenity pro člověka, skupina 3: Nezařaditelné z hlediska jejich karcinogenity pro člověka “ , na adrese http://monographs.iarc.fr , IARC,16. ledna 2009(zpřístupněno 22. srpna 2009 )
- Indexové číslo v tabulce 3.1 přílohy VI nařízení ES č. 1272/2008 (16. prosince 2008)
- „ brommethan “ v databázi chemických produktů Reptox z CSST (Quebec organizace odpovědné za bezpečnost a ochranu zdraví), přístupný 25.dubna 2009
- „ Methylbromid “ na adrese hazmap.nlm.nih.gov (přístup 14. listopadu 2009 )
- „Bromomethan“ , na ESIS , přístup 4. února 2010
- Program OSN pro životní prostředí, zpráva z třicátého zasedání smluvních stran Montrealského protokolu o látkách, které poškozují ozonovou vrstvu, rozhodnutí XXX / 9: Výjimky kritického použití pro methylbromid pro roky 2019 a 2020.
- Oplodnění oceánu: zmírnění dopadů vědeckého výzkumu na životní prostředí ; Kanadský vědecký poradní sekretariát Vědecká poradní zpráva 2010/012 (verze publikovaná v dubnu 2010 a aktualizovaná: červen 2010, konzultováno 17. 9. 2013); viz strana 9/15 PDF
- Zpráva o třicátém zasedání smluvních stran Montrealského protokolu o látkách, které poškozují ozonovou vrstvu, UNEP / Ozl.Pro.30 / 11, příloha VI, bod 74.
- „ zákaz hasicích přístrojů naplněných methylbromidem “ , o legifrance (přístup 23. ledna 2021 )
- EFSA 12/01/11 < Peer Review of the pesticide risk assessment of the active substance methyl bromide
- | http://www.ifen.fr/uploads/media/couche_ozone_01.pdf Aktuální a budoucí údaje o produkci pro Francii]
- Mechanismus atmosférické oxidace bromethanu
- Duniway, JM (2002). Stav chemických alternativ k methylbromidu pro předplodinovou fumigaci půdy . Phytopathology, 92 (12), 1337-1343.
- ANSES (2013) Analýza rizika škůdců Ditylenchus dipsaci na vojtěšce Stanovisko ANSES Souhrnná hodnotící zpráva odborníků , duben 2013, PDF, 146 stran
externí odkazy
- (en) Bezpečnostní list z INRS (2007 vydání)
- (en) Kanadský informační přehled o udržitelném a integrovaném odstraňování škůdců methylbromidu (PDF, 41p)
- MSDS : Nebezpečná chemická databáze
- ChemSub Online (Bromomethane) .