Oxaziridin
| Oxaziridin | |
| Identifikace | |
|---|---|
| Název IUPAC | Oxaziridin |
| N O CAS | |
| PubChem | 15817734 |
| ÚSMĚVY |
C1NO1 , |
| InChI |
InChI: InChI = 1S / CH3NO / c1-2-3-1 / h2H, 1H2 InChIKey: SJGALSBBFTYSBA-UHFFFAOYSA-N |
| Chemické vlastnosti | |
| Hrubý vzorec |
C H 3 N O [izomery] |
| Molární hmotnost | 45,0406 ± 0,0015 g / mol C 26,67%, H 6,71%, N 31,1%, O 35,52%, |
| Jednotky SI a STP, pokud není uvedeno jinak. | |
Tyto oxaziridiny jsou třída organických látek Heterocyclic na tři uhlík obsahující atom uhlíku , atom dusíku a jeden atom kyslíku . Oxaziridin CH 2 NHOje také mateřskou sloučeninou funkční skupiny .
Obecné vlastnosti
První deriváty oxaziridinu byly syntetizovány v padesátých letech minulého století Emmonsem, Krimmem a Hornerem a Jürgensem. Zatímco atomy kyslíku a dusíku obvykle působí jako nukleofily kvůli své vysoké elektronegativitě , oxaziridiny umožňují elektrofilní přenos dvou heteroatomů . Tato konkrétní reaktivita je způsobena přítomností vysoce omezeného tříatomového kruhu a relativní slabostí vazby NO. Tyto nukleofily mají tendenci k útoku na dusíku oxaziridin, když je substituent na atomu dusíku, je malý (typicky R 1 = H), a kyslík, když substituent na dusíkovém atomu je velmi stericky bráněný . Tyto elektronické účinky mohou být využity k provádění různé reakce přenosu kyslíku nebo atom dusíku, jako je například a-hydroxylace enolátů , na epoxidaci z alkenů nebo selektivní oxidaci sulfidů a selenidů, .
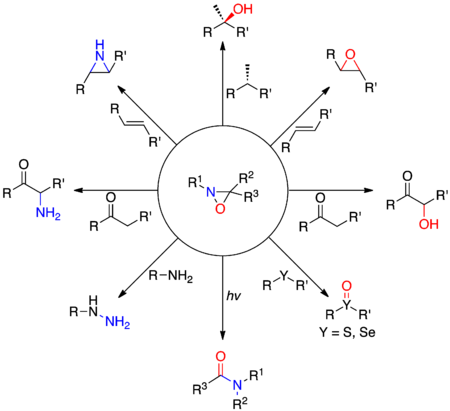
Chirality
Byly vyvinuty chirální reagencie odvozené od oxaziridinů, které umožňují reakce přenosu stereospecifických heteroatomů . Chiralita oxaziridinů může pocházet ze struktury substituentů kruhu nebo z konformace atomu dusíku ( invertomer ). Oxaziriny jsou ve skutečnosti jedinečné díky velmi vysoké bariéře inverze dusíku, která umožňuje zachování jejich stereochemické konfigurace. Tato bariérová inverze na teplotu místnosti je řádově 24 až 31 kcal · mol -1 a enantiočisté oxaziridiny byly připraveny v 80. letech .
Deriváty oxaziridinů na bázi derivátů kafru byly syntetizovány v 70. letech a staly se základním kamenem asymetrické syntézy . Z mnoha celkových syntéz využívajících oxaziridiny naznačuje celková syntéza taxolu týmy Holtona a Wendera asymetrickou α-hydroxylaci s kafrsulfonyloxaxiridinem jako klíčový krok v syntéze tohoto protirakovinného činidla.
Syntéza
NH, N-alkyl, N-aryloxaziridiny
Dvě hlavní strategie pro syntézu NH, N-alkyl a N-Aryloxaziridines jsou (a) oxidace z iminů podle perkyselin a (B) aminace z karbonylů .

Kromě toho může oxidace chirálních iminů a oxidace iminů chirálními perkyselinami vést k přípravě enantiomerně čistých oxaziridinů .
N-Sulfonyloxaziridiny
Na začátku 80. let byl připraven první N-sulfonyloxaziridin. Tyto sulfonylové deriváty se používají výhradně pro reakce přenosu kyslíkových atomů a jsou v současné době nejčastěji používanou třídou oxaziridinů. Původně připravený z m-CPBA a benzyltrimethylamoniumchloridu jako katalyzátoru fázového přenosu , zlepšení syntézy nyní umožňuje použití hydrogensíranu draselného nebo oxonu jako oxidačního činidla.
Používá se řada derivátů N-sulfonyloxaziridinů, z nichž každý má odlišné fyzikálně-chemické vlastnosti a reaktivitu. Souhrn těchto různých činidel je uveden v následující tabulce.

Perfluorované oxaziridiny
Oxaziridiny perfluorované (in) vykazují silnou reaktivitu ve srovnání s jejich ekvivalentními uhlovodíky . Perfluorované substituenty jsou akceptory elektronů, díky čemuž je reaktivita perfluorovaných oxaziridinů podobná reaktivitě dioxiranů . Perfluoralkyloxaziridiny mohou zejména hydroxylovat určité CH vazby s velmi vysokou selektivitou. Perfluorované oxaziridiny lze syntetizovat reakcí perfluorovaného iminu s perfluormethylfluorokarbonylperoxidem a fluorovaným kovem, aby se zachytil HF propuštěn.

Reakce
Přenosy atomu kyslíku
α-Hydroxylace enolátůSkupina α-hydroxyketon nebo acyloin je jednotka přítomná v mnoha přírodních produktech. Pro reprodukci tohoto motivu bylo použito mnoho syntetických cest, jako je redukce a-deiketonů, substituce hydroxylových skupin za odstupující skupinu nebo přímá oxidace enolátu . V posledně uvedeném způsobu jsou nejčastěji používanými elektrofilními zdroji kyslíku oxodiperoxymolybden (pyridin) - (hexamethylfosforečný triamid) (MoOPH) a N-sulfonyloxaziridiny . N-sulfonyloxaziridiny mají tu výhodu, že indukují větší chiralitu ve srovnání s použitím MoOPH a jiných oxidantů. Chirální indukce byla prokázána u mnoha dalších chirálních ketonů a ketonů s chirálními pomocnými látkami , jako jsou SAMP a RAMP .

Byly provedeny práce na asymetrické hydroxylaci prochirálních enolátů deriváty kafrsulfonyloxaziridinu, což umožňuje dosáhnout dobrých enantiomerních přebytků . Je všeobecně přijímáno, že přechodový stav, který umožňuje získat tuto dobrou stereochemii, zahrnuje otevřený přechodový stav, ve kterém stéricky bráněná skupina určuje stranu, ke které je molekula přiblížena.

Selektivita určitých hydroxylací se může zlepšit přidáním koordinační skupiny v poloze alfa na oxaziridinu kruhu, jako v oxaziridiny 3b a 3c ve výše uvedené tabulce. Navrhuje se, aby reakce prošla uzavřeným přechodovým stavem, ve kterém je oxyaniont kovu stabilizován chelatací díky síranu a koordinačním skupinám kafru .

Při celkové syntéze se velmi často používá a-hydroxylace oxaziridiny . Jedná se o klíčový krok v celkové syntéze taxolu Holtonem (in) a v celkové syntéze taxolu Wenderem (en) . Podobně Forsyth používá tuto reakci při syntéze systému C3-C14 (substituovaný 1,7-dioxaspiro [5,5] undec-3-en) kyseliny okadaové.
 Epoxidace alkenů
Epoxidace alkenů
Epoxidace z alkenů je široce používán v organické syntéze , protože epoxidy mohou být transformovány do mnoha funkčních skupin . Obvykle epoxidace používá m-CPBA (nebo jiné perkyseliny ), ale ukázalo se, že oxaziridny lze použít k provádění podobných syntéz a jsou velmi užitečné pro přípravu epoxidů citlivých na kyselé podmínky . Níže je popsána syntéza (-) - chaetomininu, která využívá epoxidaci alkenu oxaziridinem v jedné z posledních fází jeho syntézy.

Další široce používaná ve třídě zpracování organické syntézy je epoxidační asymetrická , jako je Sharplessova epoxidace , epoxidace Jacobsen nebo epoxidace Julia-Colonna (en) . Hlavní nevýhodou těchto reakcí je, že vyžadují velmi specifické funkce, aby byly selektivní . Ostrá epoxidace pracuje s allylalkoholy , Jacobsenova epoxidace s cis- disubstituovanými alkeny s aromatickými látkami a Juliá-Colonna epoxidace nenasycených α-β ketonů . Použití asymetrických oxaziridinů umožňuje provádět stereospecifické transformace na nefunkčních alkenech . Níže uvedené schéma ukazuje asymetrickou epoxidaci transstilbenu chirální oxaziridiniovou solí za použití oxonu jako oxidačního činidla.
 Deaktivovaná uhlovodíková hydroxylace
Deaktivovaná uhlovodíková hydroxylace
Tyto oxaziridiny perfluorované (en) je známo, že hydroxylovat jsou uhlovodíky deaktivován s vysokou regio- a diastéréospécificité . Tato reakce je velmi důležitá a několik dalších sloučenin vykazuje tento typ reaktivity. Perfluorované oxaziridiny vykazují velmi dobrou selektivitu vůči terciárním uhlíkům . Hydroxylace primárních uhlíků nebo dihydroxylace sloučenin majících dvě oxidovatelná místa nebyla nikdy pozorována. Retence stereochemie je velmi vysoká, řádově 95 až 95%, a může být dále zvýšena přidáním fluoridové soli .

Přenosy atomů dusíku
Méně pozornosti bylo věnováno oxaziridinům jako činidlům pro přenos atomů dusíku. K těmto reakcím lze použít oxaziridiny, které jsou nesubstituované nebo mají na dusíku acylovou skupinu , přičemž první příklad pochází ze šedesátých let .
Aminace N-nukleofilůAminace z nukleofilů s oxaziridiny nesubstituované na dusíku je poměrně univerzální, pokud jde o nukleofily, které mohou být použity. Tyto hydraziny mohou tedy být připraveny z z aminů sekundární nebo terciární aminy, hydroxylaminy a thiohydroxylamines na z alkoholů a thiolů , na sulfiliminu z thioethery a a-aminoketony na od enoláty .
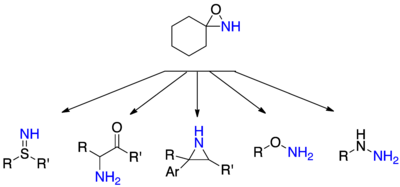 N-acylamidace
N-acylamidace
Přenos acylovaných aminů je obtížnější než u nesubstituovaných aminů. Tyto přenosové reakce byly nejprve provedeny pomocí nukleofilů, jako jsou aminy a hydraziny . Bylo také popsáno několik vzácných příkladů transferů acylovaných aminů na nukleofilní uhlíky.

Přeskupení
Oxaziridiny mohou podstoupit přeskupování reakce pod ultrafialovým zářením , pomocí a radikální mechanismu , nebo v přítomnosti redukčního činidla , jako je Cul.. Spirocyklické oxaziridiny mohou také prodloužit svůj cyklus a získat odpovídající laktam . Migrace substituentu je řízen stereoelectronic účinky, a trans- skupina o zákazu dusíku vazebné dublet převážně dává migrační produkt. Tento efekt umožňuje použít chiralitu dusíku kvůli bariéře s vysokou inverzí dusíku k usměrnění přesmyku, jak je znázorněno na následujícím obrázku. Na levé straně diagramu je pozorován výhradně termodynamicky nepříznivý produkt , zatímco na pravé straně diagramu je upřednostňován produkt odvozený od méně stabilního radikálového meziproduktu.

Tento typ přesmyku se používá v klíčovém kroku v celkové syntéze (+) - yohimbinu , což je přírodní lék, který může být účinný proti impotenci a sexuálním problémům způsobeným selektivními inhibitory zpětného vychytávání serotoninu podle tohoto léku. National Institutes of Health .

Oxaziridiny mohou také podléhat reakcím tepelného přeskupení za vzniku nitronů . Selektivita cis-trans je nízká, ale výtěžky jsou dobré. Rovněž se předpokládá, že určité oxaziridiny v průběhu času racemizují průchodem nitronovým meziproduktem .

Cycloaddions s heterocumulenes
Oxaziridiny mohou reagovat s hetero kumuleny za vzniku různých pěti atomových heterocyklů , jak je znázorněno na obrázku níže. Tato reaktivita je způsobena omezením tříatomového kruhu a slabostí vazby NO.

Poznámky a odkazy
- vypočtená molekulová hmotnost od „ atomové hmotnosti prvků 2007 “ na www.chem.qmul.ac.uk .
- (in) WD Emmons , „ Syntéza oxaziranů “ , J. Am. Chem. Soc. , sv. 78, n o 23,1956, str. 6208–6209 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja01604a072 ).
- (de) H. Krimm , " Uber Isonitrone " , Chem. Ber. , sv. 91, n o 5,1958, str. 1057-1068 ( ISSN 0009-2940 , DOI 10,1002 / cber.19580910532 ).
- (de) L. Horner a E. Jürgens , „ Notiz Über Darstellung und Eigenschaften Einiger Isonitrone (Oxazirane) “ , Chem. Ber. , sv. 90, n o 10,1957, str. 2184–2189 ( ISSN 0009-2940 , DOI 10,1002 / cber.19570901010 ).
- (en) FA Davis a AC Sheppard , „ Aplikace oxaziridinů v organické syntéze “ , Tetrahedron , sv. 45, n o 18,1989, str. 5703–5742 ( DOI 10.1016 / S0040-4020 (01) 89102-X ).
- (in) FA Davis , R. Jenkins a kol. , " 2 - [(-) - kafr-10-ylsulfonyl] -3- (nitrofenyl) oxaziridinu: nové chirální oxidační činidlo " , J. Chem. Soc., Chem. Běžný. ,1979, str. 600-601 ( ISSN 0022-4936 , DOI 10.1039 / C39790000600 ).
- (in) RA Holton , C. Somoza et al. , „ Celková syntéza První taxolu. 1. Funkcionalizace kruhu B “ , J. Am. Chem. Soc. , sv. 116, n O 4,1994, str. 1597–1598 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja00083a066 ).
- (in) RA Holton , HB Kim a kol. , „ Celková syntéza První taxolu. 2. Dokončení kruhů C a D “ , J. Am. Chem. Soc. , sv. 116, n O 4,1994, str. 1599–1600 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja00083a067 ).
- (in) PA Wender , NC Badham et al. , „ Pinen Cesta k taxany. 5. Stereokontrolovaná syntéza univerzálního prekurzoru taxanu “ , J. Am. Chem. Soc. , sv. 119, n o 11,1997, str. 2755–2756 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja9635387 ).
- (in) PA Wender , NC Badham et al. , „ Pinen Cesta k taxany. 6. Stručná stereokontrolovaná syntéza taxolu “ , J. Am. Chem. Soc. , sv. 119, n o 11,1997, str. 2757–2758 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja963539z ).
- (in) FA Davis a OD Stringer , „ Chemistry of oxaziridines. 2. Vylepšená syntéza 2-sulfonyloxaziridinů “ , J. Org. Chem. , sv. 47, n o 9,1982, str. 1774–1775 ( ISSN 0022-3263 a 1520-6904 , DOI 10.1021 / jo00348a039 ).
- .
- (en) FA Davis a BC Chen , „ Asymetrická hydroxylace enolátů N-sulfonyloxaziridiny “ , Chem. Rev. , sv. 92, n o 5,1992, str. 919–934 ( ISSN 0009-2665 a 1520-6890 , DOI 10.1021 / cr00013a008 ).
- (in) FA Davis a RH Jenkins , „ Chemistry of oxaziridines. 3. Asymetrická oxidace organosírových sloučenin za použití chirálních 2-sulfonyloxaziridinů “ , J. Am. Chem. Soc. , sv. 104, n o 20,1982, str. 5412–5418 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja00384a028 ).
- (en) FA Davis , RT Reddy a kol. , „ Chemistry of oxaziridiny. 15. Asymetrické oxidace za použití 3-substituovaných 1,2-benzisothiazol-1,1-dioxidů “ , J. Org. Chem. , sv. 56, n O 21991, str. 809-815 ( ISSN 0022-3263 a 1520 - 6904 , DOI 10,1021 / jo00002a056 ).
- (in) JC Towson , MC Weismiller et al. , " (+) - (2R, 8aS) -10- (Camphorylsulfonyl) oxaziridinu " , Org. Synth. , sv. 69,1990, str. 158 ( ISSN 0078-6209 ).
- (in) FA Davis a JC Towson , „ Chemistry of oxaziridines. 11. (Camphorylsulfonyl) oxaziridin: syntéza a vlastnosti “ , J. Am. Chem. Soc. , sv. 110, n o 25,1988, str. 8477–8482 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja00233a025 ).
- (en) RD Bach , BA Coddens et al. , „ Mechanismus přenosu kyslíku z oxaziridin k sulfidu a sulfoxid: teoretická studie “ , J. Org. Chem. , sv. 55, n o 10,1990, str. 3325–3330 ( ISSN 0022-3263 a 1520-6904 , DOI 10.1021 / jo00297a062 ).
- (in) FA Davis , A. Kumar a kol. , „ Chemistry of oxaziridiny. 16. Krátká, vysoce enantioselektivní syntéza segmentů AB-kruhu y-rhodomyciononu a a-citromycinonu za použití (+) - [(8,8-dimethoxykamforyl) sulfonyl] oxaziridinu “ , J. Org. Chem. , sv. 53, n o 3,1991, str. 1143–1145 ( ISSN 0022-3263 a 1520-6904 , DOI 10.1021 / jo00003a042 ).
- (en) FA Davis , MC Weismiller et al. , „ (Camphorylsulfonyl) imin dianion při syntéze nových opticky čistých (camphorylsulfonyl) oxaziridinových derivátů “ , Tetrahedron Lett. , sv. 30, n o 13,1989, str. 1613-1616 ( ISSN 0040-4039 , DOI 10.1016 / S0040-4039 (00) 99534-0 ).
- (in) BC Chen , MC Weismiller et al. , „ Enantioselektivní syntéza (+) - kjellmanianone “ , Tetrahedron , sv. 47, n O 21991, str. 173–182 ( ISSN 0040-4020 , DOI 10.1016 / S0040-4020 (01) 80914-5 ).
- (en) VA Petrov a G. Resnati , „ Polyfluorované oxaziridiny: syntéza a reaktivita “ , Chem. Rev. , sv. 96, n o 5,1996, str. 1809–1824 ( ISSN 0009-2665 a 1520-6890 , DOI 10.1021 / cr941146h ).
- (in) DA Evans , pan Morrissey a kol. , „ Asymmetric okysličování chirálních imidové enoláty. Obecný přístup k syntéze enantiomerně čistých synthonů a-hydroxykarboxylové kyseliny “ , J. Am. Chem. Soc. , sv. 107, n o 14,1985, str. 4346–4348 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja00300a054 ).
- (in) RA Holton , HB Kim a kol. , „ Celková syntéza První taxolu. 2. Dokončení kruhů C a D “ , J. Am. Chem. Soc. , sv. 116, n O 4,1994, str. 1599–1600 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja00083a067 ).
- (in) PA Wender , NC Badham et al. , „ Pinen Cesta k taxany. 5. Stereokontrolovaná syntéza univerzálního prekurzoru taxanu “ , J. Am. Chem. Soc. , sv. 119, n o 11,1997, str. 2755–2756 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja9635387 ).
- (in) AB Dounay a CJ Forsyth , „ Zkrácená syntéza systému kyseliny Okadaic C3-C14 (substituovaný 1,7-dioxaspiro [5,5] undec-3-en “) , Org. Lett. , sv. 1, n o 3,1999, str. 451-454 ( ISSN 1523 až 7060 a 1523 až 7052 , DOI 10,1021 / ol9906615 ).
- (en) B. Malgesini , B. Forte et al. , „ Přímou celkovou syntézu (-) - chaetominin “ , Chem. Eur. J. , sv. 15, n o 32,2009, str. 7922–7929 ( ISSN 0947-6539 a 1521-3765 , DOI 10.1002 / chem.200900793 ).
- (in) L. Bohé G. Hanquet a kol. , „ Stereospecifickou syntézou nové chirální oxaziridiniové soli “ , Tetrahedron Lett. , sv. 34, n o 45,1993, str. 7271–7274 ( ISSN 0040-4039 , DOI 10.1016 / S0040-4039 (00) 79306-3 ).
- (in) A. Arnone , S. Foletto a kol. , „ Vysoce enantiospecifickou oxyfunctionalization z neaktivovaných uhlovodíkových míst plynným perfluor-cis-2-n-butyl-3-n-propyloxaziridine “ , Org. Lett. , sv. 1, n O 21999, str. 281–284 ( ISSN 1523-7060 a 1523-7052 , DOI 10.1021 / ol990594e ).
- (de) E. Schmitz , R. Ohme a kol. , „ Isomere Oxim mit Dreiringstruktur “ , Chem. Ber. , sv. 97, n o 9,1964, str. 2521–2526 ( ISSN 0009-2940 , DOI 10,1002 / cber.19640970916 ).
- (en) S. Andeae a E. Schmitz , „ Elektrofilní aminace s oxaziridiny “ , Synthesis , n o 5,1991, str. 327-341 ( ISSN 0039-7881 a 1437-210X , DOI 10.1055 / s-1991-26459 ).
- (en) J. Aubé , „ Oxiziridinové přesmyky v asymetrické syntéze “ , Chem. Soc. Rev. , sv. 26, n O 4,1997, str. 269-277 ( ISSN 0306 až 0012 a 1460 až 4744 , DOI 10,1039 / CS9972600269 ).
- (en) A. Lattes , E. Oliveros et al. , „ Fotochemické a termální přesmyk oxaziridiny. Experimentální důkazy na podporu teorie stereoelektronického řízení “ , J. Am. Chem. Soc. , sv. 104, n o 14,1982, str. 3929–3934 ( ISSN 0002-7863 a 1520-5126 , DOI 10.1021 / ja00378a024 ).
- „ Yohimbe, “ z nlm.nih.gov (přístup 27. srpna 2012 ) .
- ( fr ) Tento článek je částečně nebo zcela převzat z anglického článku Wikipedie s názvem „ Oxaziridin “ ( viz seznam autorů ) .