Cyklohexan
| cyklohexan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
    Různá znázornění molekuly cyklohexanu. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Název IUPAC | cyklohexan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne o ECHA | 100 003 461 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne o EC | 203-806-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | DB03561 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 8078 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 29005 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ÚSMĚVY |
C1CCCCC1 , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C6H12 / c1-2-4-6-5-3-1 / h1-6H2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | bezbarvá kapalina | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemické vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hrubý vzorec |
C 6 H 12 [izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární hmotnost | 84,1595 ± 0,0056 g / mol C 85,63%, H 14,37%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetická susceptibilita | 68,1 × 10 -6 cm 3 · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzikální vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T. fúze | 6,47 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° vroucí | 80,75 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpustnost | ve vodě: žádný; přízemní. v alkoholu , etheru , acetonu ; |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametr rozpustnosti δ | 16,8 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Objemová hmotnost |
0,7786 g · cm -3 ( 25 ° C )
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota samovznícení | 260 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bod vzplanutí | −18 ° C (uzavřený kelímek) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Meze výbušnosti ve vzduchu | 1,3 - 8,4 % obj | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tlak nasycených par | při 20 ° C : 12,7 kPa
rovnice:
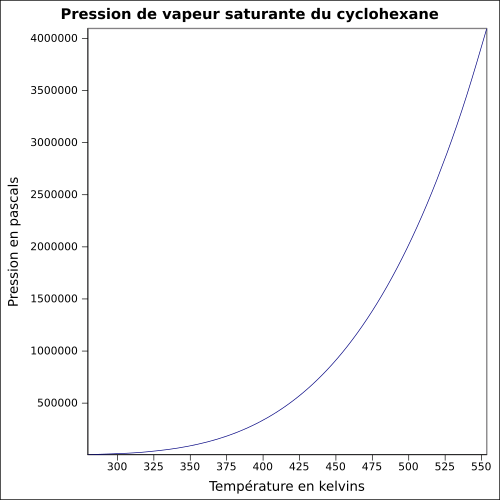
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dynamická viskozita | 0,98 mPa · s při 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritický bod | 280,3 ° C , 40,7 bar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 1280 m · s -1 až 19 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° | 3,6 x 10 5 J · kg-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C str |
rovnice:
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 3 919,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optické vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Index lomu | 1,42662 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opatření | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
    Nebezpečí H225, H304, H315, H336, H410, H225 : Vysoce hořlavá kapalina a páry H304 : Při požití a vniknutí do dýchacích cest může způsobit smrt H315 : Dráždí kůži H336 : Může způsobit ospalost nebo závratě H410 : Vysoce toxický pro vodní organismy, pro vodní organismy. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B2, D2B, B2 : Bod vzplanutí hořlavé kapaliny = −18 ° C uzavřený kelímek Metoda Setaflash D2B : Toxický materiál způsobující jiné toxické účinky podráždění kůže u zvířat 1,0% zveřejnění podle seznamu zveřejněných složek |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 1 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Doprava | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
33 : vysoce hořlavý kapalný materiál (bod vzplanutí pod 21 ° C ) UN číslo : 1145 : CYKLOHEXANE Třída: 3 Štítek: 3 : Hořlavé kapaliny Balení: Obalová skupina II : mírně nebezpečné látky;  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoxikologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | 930 - 1360 mg · kg -1 (potkani, orálně) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 3.44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prahová hodnota zápachu | nízká: 0,52 ppm vysoká: 784 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednotky SI a STP, pokud není uvedeno jinak. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cyklohexan je uhlovodík alicyklický non-ethylen rodiny (mono) cykloalkany vzorce surový C 6 H 12 . Cyklohexan se používá jako nepolární rozpouštědlo v chemickém průmyslu, ale také jako činidlo pro průmyslovou výrobu kyseliny adipové a kaprolaktamu , meziproduktů používaných při výrobě nylonu . Kosterní vzorec cyklohexanu je znázorněn pravý opak.
Výroba
Historické souhrny
Na rozdíl od jiných uhlovodíků nelze cyklohexan v přírodě nalézt. Několik chemiků se proto snažilo syntetizovat to:
- V roce 1867 Marcelin Berthelot pokračuje s redukcí z benzenu podle jodovodíkové kyseliny při zvýšené teplotě. Pojmenoval svůj produkt hexahydrobenzen v domnění, že jej syntetizoval. V roce 1870 Adolf von Baeyer tuto reakci zopakoval a získal stejný produkt.
- V roce 1890 si Vladimir Markovnikov myslel, že by mohl získat stejný produkt destilací kavkazské ropy. Pojmenuje svůj konečný produkt hexanafthen.
Oba produkty však mají teplotu varu asi o 10 ° C vyšší než hexahydrobenzen a hexanaften v tabulkách. V roce 1895 tuto nesrovnalost upozornili V. Markovnikov , N. Kischner (en) a N. Zelinsky, kteří ukazují, že získané produkty mají strukturu typu methylcyklopropanu získanou neočekávanou přesmykovou reakcí .
To nebylo až do roku 1894, který Baeyer syntetizovaného poprvé od cyklohexanu Dieckmann kondenzací z pimelová , následovaný několika fázích snížení .

Ve stejném roce E. Haworth a WH Perkin Jr. (ne) syntetizovali cyklohexan provedením Wurtzovy reakce s 1,6-dibromhexanem .

Syntéza proudu
V současné době, cyklohexan se vyrábí v průmyslovém měřítku hydrogenací z benzenu za katalýzy Raneyovým niklem . Produkce cyklohexanu odpovídá přibližně 10% roční světové potřeby benzenu . Reakce se provádí při vysoké teplotě, poté je vysoce exotermická s ΔH (500 K) = -216,37 kJ / mol. Dehydrogenační reakce je významná pouze od 300 ° C , což odráží negativní entropii reakce pro hydrogenační reakci.

Použití
Jako uhlovodík je cyklohexan slabě reaktivní molekula. Převážná většina cyklohexanu se však obvykle používá k katalytické oxidaci na cyklohexanol a cyklohexanon . Tyto dvě sloučeniny se používají při výrobě kyseliny adipové , která se používá jako surovina pro výrobu nylonu-6,6 , a při výrobě kaprolaktamu , prekurzoru nylonu-6 . Každý rok se vyprodukuje několik tisíc tun cyklohexanolu a cyklohexanonu .
Cyklohexan se také používá jako nepolární organické rozpouštědlo, i když dnes má přednost n-hexan . Často se používá jako rekrystalizační rozpouštědlo, protože mnoho organických sloučenin je v cyklohexanu rozpustných za tepla, ale ne studených.
Cyklohexan se také používá ke kalibraci přístrojů pro diferenciální skenovací kalorimetrii kvůli jeho čisté změně krystalické fáze při 186 K. Výpary cyklohexanu se také používají v zařízeních na tepelné zpracování zařízení.
Geometrie
Historický přístup
V roce 1890 vydal Hermann Sachse (de) , 28letý berlínský asistent, pokyny pro skládání listu papíru tak, aby představoval dvě formy cyklohexanu, které nazval „symetrické“ a „antisymetrické“ (dnes nazývané židle a loď). . Chápe, že pro každý tvar existují dvě odlišné polohy pro atomy vodíku (nyní nazývané axiální a ekvatoriální), že dva „symetrické“ tvary se mohou vzájemně převádět a dokonce i to, jak mohou určité substituenty upřednostňovat jeden nebo druhý tvar. Jiné ( Sachse-Mohrova teorie (de) ). Bohužel vyjadřuje všechna svá zjištění v matematickém jazyce a jen málo chemiků mu rozumí. Zemřel v roce 1893, aniž by se jeho nápady mohly rozvíjet.
V roce 1918 převzal dílo Sachse Ernst Mohr (de) . Studuje všechny cykloalkany, aby rozšířil svou teorii. Předpovídá zejména, že existují dvě stabilní formy stejné energie pro dekalin , což potvrdí Walter Hückel (de) v roce 1925. Mohr bude mít také představu, že rentgenová difrakce by mohla umožnit ověření jeho teorie, ale technika je příliš nová na to, aby mohla být spolehlivě použita.
Teprve v roce 1943 mohl Odd Hassel prokázat existenci těchto dvou konformací a dvou nerovnocenných poloh atomů vodíku studiem par cyklohexanu elektronovou difrakcí .
Hlavní konformace cyklohexanu
Protože mnoho sloučenin má šestičlennou prstencovou strukturu, jsou struktura a dynamika cyklohexanu důležitými prototypy. Úhly pravidelného šestiúhelníku jsou 120 °. Úhel tvořený dvěma po sobě následujícími vazbami v uhlíkovém řetězci je však podle teorie VSEPR přibližně 109 ° . Molekula cyklohexanu proto není plochá, aby minimalizovala stres cyklu.
Převládající konformace cyklohexanu při pokojové teplotě se nazývá konformační křeslo. Více než 99% molekul cyklohexanu v roztoku přijímá tuto konformaci při 25 ° C. Všechny atomy uhlíku jsou zde ekvivalentní a pro atomy vodíku existují dvě odlišné polohy: atom vodíku, který patří do střední roviny cyklu, se říká, že je v rovníkové poloze, zatímco atom vodíku, který nepatří do této roviny, je říká se, že je v axiální poloze. Každý atom uhlíku je proto spojen s atomem vodíku v axiální poloze a s dalším v rovníkové poloze. Postupné vazby uhlík-vodík jsou posunuty, což minimalizuje torzní napětí kruhu.
Druhou stabilní konformací molekuly cyklohexanu je konformace twist-boat . Pokud je podíl molekul cyklohexanu v této konformaci pouze asi 0,1% při 25 ° C, dosahuje 30% při 800 ° C. Náhlé ochlazení vzorku poté umožňuje „zmrazit“ konformaci různých molekul. Konformace zkrouceného člunu je méně stabilní než konformace křesla, a proto je v přírodě neobvyklá. Můžeme si povšimnout případu twistanu , syntetického izomeru adamantanu , jehož všechny cyklohexany jsou ve zkroucené lodní konformaci.
Inverze konformace židle
Ve skutečnosti existují dvě různé konformace křesla a molekula cyklohexanu může změnit svou rovnovážnou konformaci mezi těmito dvěma formami. Atomy vodíku v axiální poloze v jedné konformaci křesla se nacházejí v rovníkové poloze ve druhé a naopak. Tyto dvě konformace křesla jsou v rychlé rovnováze při teplotě místnosti, a proto jsou nerozeznatelné protonovou NMR při 25 ° C. Podrobný mechanismus inverze konformace křesla byl předmětem mnoha studií a debat, ale dnes je známý.
Energetický profil inverze konformace křesla je také známý. Konformace napůl křesla je stav přechodu umožňující dosažení první konformace zkroucené lodi a konformace lodi je stav přechodu mezi dvěma konformacemi zkroucené lodi. Aktivační energie inverze konformace křesla je 43 kJ / mol, což je méně než energie tepelného míchání při 25 ° C: proto jsou obě konformace křesla v teplotní rovnováze.
Většinová konformace substituovaných derivátů cyklohexanu
Monosubstituované derivátyDvě konformace křesla cyklohexanu mají stejnou energii. Na druhou stranu, pokud je atom vodíku nahrazen substituentem, tyto dvě konformace již nemají stejnou energii. V křeslové konformaci je substituent v axiální poloze, zatímco v druhé je v rovníkové poloze. V axiální poloze způsobuje substituent sterické nepohodlí s dalšími dvěma atomy vodíku v axiální poloze: tyto interakce se nazývají 1,3-diaxiální interakce. V rovníkové poloze tyto interakce neexistují: je to tedy křeslová konformace, pro kterou je substituent v rovníkové poloze, která má nižší energii. Rozdíl ve volné entalpii mezi těmito dvěma křeslovými konformacemi se nazývá faktor A a silně závisí na substituentu. Hodnota A se pohybuje od téměř nuly pro malé substituenty, jako je deuterium, do přibližně 21 kJ / mol pro velké substituenty, jako je terc-butylová skupina.
Disubstituované derivátyZvažte, že dva substituenty jsou v relativní poloze 1,2 nebo 1,4. Jsou-li v cis konfiguraci , obě křeslové konformace mají obě skupinu v axiální poloze a další v rovníkové poloze: obě konformace křesla mají stejnou energii. Na druhou stranu, pokud jsou dva substituenty v trans konfiguraci , může významně existovat pouze křeslová konformace mající dvě skupiny v rovníkové poloze, protože silné 1,3-diaxiální interakce zabraňují tomu, aby tyto dvě skupiny byly v axiální poloze zároveň.
Uvažujme, že dva substituenty jsou nyní v relativní poloze 1,3. Pokud jsou v cis konfiguraci , případ je podobný trans konfiguraci pro substituenty v relativní poloze 1,2 nebo 1,4. Naopak, pokud jsou v trans konfiguraci , případ je podobný cis konfiguraci pro substituenty v relativní poloze 1,2 nebo 1,4.
Pokud jsou substituenty velmi objemné, konformace křesla nemusí být nejstabilnější: v případě cis -1,4-di-terc-butylcyklohexanu umožňuje konformace zkrouceného člunu umístit obě skupiny do výhodnější polohy než pro konformaci židle, pro kterou je terc-butylová skupina v axiální poloze. Bylo tedy měřeno pomocí NMR , že konformace zkrouceného člunu byla stabilnější o 0,47 kJ / mol při 125 K než konformace křesla.
Heterocyklické analogy
Heterocyklické analogy cyklohexanu jsou mimo jiné všudypřítomné v oblasti cukrů , piperidinů nebo dioxanů . Konformace křesla je obecně nejstabilnější, ale hodnoty faktoru A se velmi liší, když se methylenová skupina nahradí atomem kyslíku nebo dusíku, což dokazuje anomerní účinek . Můžeme si také povšimnout určitých heterocyklických analogů, jako je 1,2,4,5-tetrathian (SCH 2 S) 2, pro které 1,3-diaxiální interakce neexistují: mnohem více molekul je pak ve zkroucené lodní konformaci. Pro svůj tetramethylový analog, 3,3,6,6-tetramethyl-1,2,4,5-tetrathian, je převládající konformace krouceného člunu.
Toxicita a rizika
Toxicita
Kvůli toxicitě cyklohexanu existují limitní hodnoty expozice k ochraně osob pracujících s touto sloučeninou:
- mezi 300 a 375 ppm ve Francii, v závislosti na délce expozice,
- 200 ppm v Německu,
- 100 ppm ve Spojených státech.
Hořlavost
Cyklohexan je velmi hořlavý. Únik cyklohexanu v britské továrně ve Flixborough způsobil v roce 1974 výbuch, při kterém zahynulo 28 lidí pracujících na místě.
Poznámky a odkazy
- CYKLOHEXANE , bezpečnostní listy Mezinárodního programu pro bezpečnost chemických látek , konzultovány 9. května 2009
- (in) Hyp Daubensee J., Jr. , James D. Wilson a John L. Laity, „ Diamagnetic Susceptibility Exaltation in Hydrocarbons “ , Journal of the American Chemical Society , sv. 91, n o 8,9. dubna 1968, str. 1991-1998
- vypočtená molekulová hmotnost od „ atomové hmotnosti prvků 2007 “ na www.chem.qmul.ac.uk .
- „Cyklohexan“ v databázi nebezpečných látek , přístup k 5. května 2010
- (in) Iwona Owczarek a Krystyna Blazej, „ Doporučené kritické teploty. Část II. Aromatické a cyklické uhlovodíky “ , J. Phys. Chem. Čj. Data , roč. 33, n O 230.dubna 2004, str. 541 ( DOI 10.1063 / 1.1647147 )
- (in) James E. Mark, Fyzikální vlastnosti příručky pro polymery , Springer,2007, 2 nd ed. , 1076 str. ( ISBN 978-0-387-69002-5 a 0-387-69002-6 , číst online ) , s. 294
- (in) JG Speight, Norbert Adolph Lange, Lange's Handbook of Chemistry , New York, McGraw-Hill ,2005, 16 th ed. , 1623 s. ( ISBN 978-0-07-143220-7 , LCCN 84643191 ) , s. 2289
- (en) Robert H. Perry a Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill ,1997, 7 th ed. , 2400 s. ( ISBN 978-0-07-049841-9 , LCCN 96051648 ) , s. 2-50
- „ Vlastnosti různých plynů “ na adrese flexwareinc.com (přístup 12. dubna 2010 )
- (in) William M. Haynes , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press / Taylor and Francis,1 st 07. 2010, 91 th ed. , 2610 s. ( ISBN 9781439820773 , online prezentace ) , s. 14-40
- (in) Carl L. Yaws, Příručka termodynamických diagramů: Organické sloučeniny C5 až C7 , sv. 2, Huston, Texas, Gulf Pub. Co.,1996, 400 s. ( ISBN 978-0-88415-858-5 , LCCN 96036328 )
- Indexové číslo v tabulce 3.1 přílohy VI nařízení ES č. 1272/2008 (16. prosince 2008)
- „ Cyklohexan “ v databázi chemických produktů Reptox z CSST (Quebecská organizace odpovědná za bezpečnost a ochranu zdraví při práci), přístup k 24. dubnu 2009
- Cyklohexan na ChemIDplus
- „ Cyklohexan “ na adrese hazmap.nlm.nih.gov (přístup 14. listopadu 2009 )
- M. Piraux, Statická organická chemie , Office international de librairie, Brusel, str. 35 ( ISBN 978-2-87343-001-6 )
- (in) EW Warnhoff , „ The Curiously Intertwined Histories of Benzene and Cyclohexane “ , Journal of Chemical Education , sv. 73, n O 6,Červen 1996, str. 494 ( ISSN 0021-9584 a 1938-1328 , DOI 10.1021 / ed073p494 , číst online , přistupováno 19. dubna 2020 )
- Bertholet (1867) „Nové aplikace redukčních metod v organické chemii“ , Bulletin of Chemical Society of Paris , série 2, 7 : 53-65.
- Bertholet (1868) „Univerzální metoda redukce a nasycení organických sloučenin vodíkem“, Bulletin de la Société Chimique de Paris , série 2, 9 : 8-31
- Adolf Baeyer (1870) „Ueber die Reduction aromatischer Kohlenwasserstoffe durch Jodphosphonium“ (O redukci aromatických sloučenin fosfonium jodidem [H 4 IP]), Annalen der Chemie und Pharmacie , 155 : 266-281
- Fred Fan Zhang, Thomas van Rijnman, Ji Soo Kim, Allen Cheng „O současných metodách hydrogenace aromatických sloučenin, 1945 až dodnes“ Lunds Tekniska Högskola 2008
- Ceresana, " Benzen - studie: trh, analýza, trendy 2021 - Ceresana " [ archiv z21. prosince 2017] , na www.ceresana.com (přístup 4. května 2018 )
- (in) Michael Tuttle Musser , „Cyclohexanol and Cyclohexanone“ v Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH Verlag GmbH & Co. KGaA,15. června 2000( ISBN 978-3-527-30673-2 , DOI 10.1002 / 14356007.a08_217 , číst online ) , a08_217
- (in) DM Price, „ Temperature Calibration of Differential Scanning calorimeters “ , Journal of Thermal Analysis , vol. 45, n O 6,1995, str. 1285–1296 ( DOI 10.1007 / BF02547423 )
- Tento příběh je shrnut zde: https://web.archive.org/web/20120228222221/https://webspace.yale.edu/chem125/125/history99/6Stereochemistry/Baeyer/Sachse.html archivováno 28. 2. 2012 na Wayback Machine
- (in) „ Odd Hassel - Biographical “ na nobelprize.org (přístup ke dni 20. dubna 2020 )
- (in) Gurvinder Gill , pan Diwakar Pawar a Eric A. Noe , „ Konformační studie cis-1,4-di-terc-butylcyklohexanu pomocí dynamické NMR spektroskopie a výpočetních metod. Pozorování shody křesla a Twist-Boat “ , The Journal of Organic Chemistry , sv. 70, n o 26,prosince 2005, str. 10726–10731 ( ISSN 0022-3263 a 1520-6904 , DOI 10.1021 / jo051654z , číst online , přístup ke dni 20. dubna 2020 )
- INRS, toxikologické výkres č 17, dokumentární notebooky - ochrana zdraví a bezpečnost - N o 190, 1 st čtvrtletí 2003
- ministerstva odpovědný za životní prostředí - DPPR / SEI / BARPI N o 5611










