Ethanol
| Ethanol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Molekula ethanolu |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Název IUPAC | Ethanol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyma |
ethylalkohol |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne o ECHA | 100 000 526 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne o EC | 200-578-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC kód | D08 , V03 , V03 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | DB00898 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 702 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 16236 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O E | E1510 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2419 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ÚSMĚVY |
CCO , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C2H6O / c1-2-3 / h3H, 2H2,1H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | bezbarvá kapalina s charakteristickým zápachem. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemické vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hrubý vzorec |
C 2 H 6 O [izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární hmotnost | 46,0684 ± 0,0023 g / mol C 52,14%, H 13,13%, O 34,73%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolární moment | 1,66 D. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekulární průměr | 0,469 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzikální vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T. fúze | -114 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° vroucí | 79 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpustnost | ve vodě: mísitelný, Kompletní v polárních a nepolárních rozpouštědlech ( aceton , diethylether ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametr rozpustnosti δ |
26,0 MPa 1/2 ( 25 ° C ); 11,2 kcal 1/2 · cm -3/2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Objemová hmotnost |
0,789
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota samovznícení |
423 až 425 ° C ; 363 ° C (v závislosti na zdrojích) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bod vzplanutí | uzavřený kelímek: 13 ° C čistý 17 ° C 95 % objem . 21 ° C 70 % obj . 49 ° C 10 % obj . 62 ° C, 5 % objem . |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Meze výbušnosti ve vzduchu | Dolní: 3,3 % obj. Horní: 19 % obj |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tlak nasycených par | při 20 ° C : 5,8 kPa
rovnice:
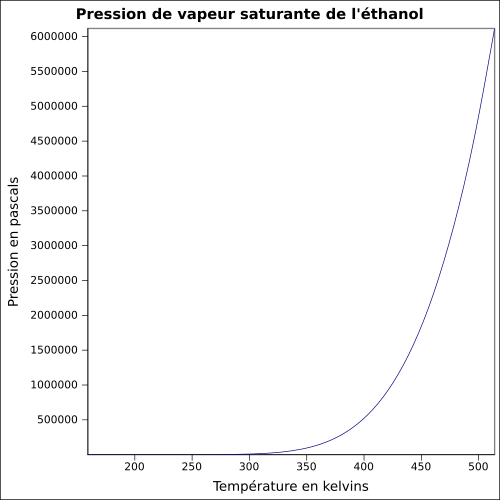
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dynamická viskozita | 1,20 × 10 -3 Pa s při 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritický bod | 240,85 ° C , 6,14 MPa , 0,168 l mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 1162 m s -1 při 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 kapalina, 1 bar | 159,86 J · mol -1 · K. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 plyn | -235,3 kJ mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 kapalina | −277,0 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C str |
111 J · K -1 · mol -1
rovnice:
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 1 366,8 kJ · mol -1 (kapalina) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronické vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ionizační energie | 10,43 ± 0,05 eV (plyn) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Křišťálová třída nebo vesmírná skupina | Pc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parametry sítě |
a = 5,377 Á b = 6,882 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Objem | 298,57 Á 3 hustota = 0,7893 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optické vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Index lomu | 1,3594. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opatření | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Nebezpečí H225, P210, P305 + P351 + P338, P370 + P378, P403 + P235, H225 : Vysoce hořlavá kapalina a páry P210 : Chraňte před teplem / jiskrami / otevřeným plamenem / horkými povrchy. - Kouření zakázáno. P305 + P351 + P338 : Při zasažení očí: Několik minut opatrně vyplachujte vodou. Vyjměte kontaktní čočky, pokud je oběť nosí a lze je snadno vyjmout. Pokračujte v oplachování. P370 + P378 : V případě požáru: K hašení použijte…. P403 + P235 : Uchovávejte na dobře větraném místě. Zachovat chladnou hlavu. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 2 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Doprava | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
33 : vysoce hořlavá kapalina (bod vzplanutí pod 21 ° C ) UN číslo : 1170 : ETHYL ALKOHOL obsahující více než 24% objemových ethanolu; ROZTOK ETHYLALKOHOLU obsahující více než 24% objemových ethanolu; ETHANOL obsahující více než 24 objemových procent ethanolu; nebo ROZTOK ETHANOLU obsahující více než 24% objemových ethanolu Třída: 3 Štítek: 3 : Hořlavé kapaliny Balení: Obalová skupina II : středně nebezpečné materiály;  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klasifikace IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina 1: Karcinogenní pro člověka | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inhalace | intoxikace, nevolnost, zvracení | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kůže | žádný efekt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oči | nebezpečný | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Požití | intoxikace, nevolnost, zvracení, ethyl kóma (které může vést k smrti) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoxikologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | 5 až 20 g kg -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | 20 000 až 30 000 ppm po dobu 4 až 6 hodin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | -0,32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prahová hodnota zápachu | nízká: 49 ppm vysoká: 716 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Farmakokinetické údaje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Metabolismus | v játrech v ethanalu a poté v kyselině octové při ~ 100 mg kg -1 za hodinu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Psychotropní charakter | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategorie | Depresivum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Způsob konzumace |
Požití |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ostatní jména |
Alkohol (viz Alkoholické nápoje ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Riziko závislosti | Student | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednotky SI a STP, pokud není uvedeno jinak. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ethanol, nebo ethylalkohol (nebo jednodušeji alkohol ) je alkohol ze strukturního vzorce CH 3 -CH 2 -OH. Je to bezbarvá kapalina, těkavá , hořlavá a mísitelná s vodou ve všech poměrech. Je to droga měnící mysl a jedna z nejstarších rekreačních drog ve formě alkoholického nápoje . Ethanol se používá v potravinářském průmyslu (zejména k výrobě lihovin ), parfumerie a farmaceutických farmaceutik (jako rozpouštědlo ) a také v biopalivech ( bioethanol ). Používá se také v alkoholických teploměrech .
Vzorec
Ethanol je dvou-uhlík primární alkohol ze surového vzorce C 2 H 6 Oa semi-strukturního vzorce CH 3 CH 2 OHnebo CH 3 -CH 2 -OH, Což ukazuje, že atom uhlíku methylové skupiny (CH 3 -) Je připojen k methandiyl skupinu (-CH 2 -) sám připojený k hydroxylové skupině (-OH). Je to ústava izomer z methyletheru . Ethanol se obvykle označuje zkratkou „EtOH“, což je ethylová skupina (C 2 H 5 -) je v organické chemii běžně zkráceno „A“ .
Příjmení
Ethanol je systematický název definovaný nomenklaturou organických sloučenin pro molekulu se dvěma atomy uhlíku (předpona eth- ), která má mezi sebou jednoduchou vazbu (přípona -an ) a připojenou k hydroxylové skupině (přípona -ol ).
Dějiny
Fermentace z cukrů na ethanol, je jedním z nejstarších biotechnologie používané lidmi, zejména v odvětví výroby alkoholu a byl používán od pravěku získat alkoholické nápoje . Chemické analýzy organických sloučenin absorbuje ve sklenicích datovat od neolitu nalezen ve vesnici v provincii Henan v Číně , bylo zjištěno, že směsi kvašených nápojů sestávající z rýže, med a ovoce byly vyrobeny z VII Th tisíciletí před naším letopočtem. AD .
Přestože je destilace je technika známá alchymisté řecko-egyptského (jako zosimos z Panopole ), první písemné zmínky o výrobě alkoholu z vína sahá pouze XII tého století s prací alchymistů na School of Medicine Salerna . První zmínka o rozdílu mezi absolutní alkohol a voda-alkohol směsi se hlásil na XIII -tého století od Raymond Lully . Mějte však na paměti, že se naučil perské Rhazes izolovali etanolu v aktuální X -tého století.
V roce 1796 , Johann Tobias Lowitz získá čistý ethanol filtrací destilované ethanolu přes aktivní uhlí . Antoine Lavoisier určí, že ethanol je složena z uhlíku , kyslíku a vodíku , a v roce 1808 , Nicolas Théodore de Saussure určuje jeho surového vzorec . V roce 1858 , Archibald Scott Couper publikoval chemickou strukturu ethanolu, který byl jedním z prvních struktur určených.
Ethanol byl poprvé synteticky připraven v roce 1826 nezávislou prací Georges Serullas ve Francii a Henry Hennel ve Velké Británii . V roce 1828 , Michael Faraday syntetizován ethanolu podle kysele katalyzovanou hydratací z ethylenu , syntéza podobný průmyslový proces použitý dnes.
Ethanol se také používal jako palivo do lamp a jako palivo pro automobily až do 30. let . Například Ford T mohl běžet až do roku 1908 na čistý ethanol.
Přirozená přítomnost
Ethanol je těkavý vedlejším produktem z kvasinek metabolismu . Je tedy přítomen ve stanovišti těchto organismů a v naší atmosféře. Rovněž se zjistí, že jsou emitovány zralými plody a v mnoha rostlinách v důsledku přirozených anaerobních podmínek během klíčení nebo když rostliny bez kyslíku (například v případě zaplavení) získávají energii z fermentace.
Na počátku dvacátých let byl jeho atmosférický cyklus stále špatně pochopen. Snažíme se kvantifikovat ethanol emitovaný rostlinami a kvasinkami, jeho hladiny v atmosféře a jeho rychlost přeměny prostřednictvím hydroxylové skupiny vzduchu (titrací methylchloroformu ). První hrubý odhad stanovil míru emisí ethanolu rostlinami mezi 10 a 38 Tg / rok, tj. Hlavní příspěvek k odhadovanému celkovému množství ethanolu zavedeného do atmosféry ročně (mezi 25 a 56 Tg / rok). Rok). Poté nová práce revidovala emise rostlin směrem nahoru: 70 Tg / rok (od 50 do 90 Tg / rok), přibližně 75% ethanolu zavedeného ze vzduchu bylo ve skutečnosti zničeno reakcí s hydroxylovými radikály v suchém nebo vlhkém vzduchu. Suché a mokré usazeniny také existují.
Ethanol byl také detekován ve vesmíru a pokrýval v pevné formě prachová zrna v mezihvězdných mracích .
Fyzikálně-chemické vlastnosti
Ethanol je těkavá , bezbarvá kapalina, která má zápach. Jeho spalování je bez kouře a dává modravý plamen. Fyzikálně-chemické vlastnosti ethanolu pocházejí hlavně z přítomnosti hydroxylové skupiny a krátkého uhlíkového řetězce . Hydroxylová skupina může tvořit vodíkové vazby , což ethanol více viskózní a méně těkavé než organických rozpouštědel z ekvivalentních molekulových hmotností . Index lomu ethanolu je vyšší než voda (1.3594 při 25,0 ° C ). Trojný bod ethanolu je pozorována při -123.15 ° C za tlaku 4,3 x 10 -4 Pa .
Vlastnosti jako rozpouštědlo
Ethanol je polární protické rozpouštědlo . Je mísitelný s mnoha organickými rozpouštědly , jako jsou chlorovaná rozpouštědla ( tetrachlormethan , chloroform , trichlorethan , tetrachlorethylen ), alifatické uhlovodíky ( pentan , hexan ), aromatická rozpouštědla ( benzen , toluen , pyridin ), kyselina octová , aceton , diethylether je ethylenglykol nebo nitromethan . Nicméně, mísitelnosti ethanolu s alifatickými uhlovodíky, má tendenci klesat s nárůstem délky uhlíkového řetězce alkanu a poklesem teploty, na hranici mísitelnosti bytí například 13 ° C po dobu dodekanu. .
Vzhledem k polární povahy z hydroxylové skupiny , ethanol lze také rozpustit iontové sloučeniny , jako jsou například sodné a draselné hydroxidy , hořčíku , vápníku a amonné chloridy, nebo amonné a sodné bromidy. . Chloridy sodné a draselné jsou v ethanolu jen málo rozpustné.
Nepolární část ethanolu mu umožňuje rozpouštět hydrofobní látky , zejména éterické oleje a mnoho vonných, barvících a léčivých sloučenin.
Ethanol lze použít jako rozpouštědlo v mnoha chemických reakcích během syntéz , například v nukleofilních substitucích S N 1 , během katalytických hydrogenací , během aldolových reakcí , během Wittigových reakcí , během Dielsových reakcí. Olše nebo během diazotačních reakcí .
Ethanol je inertní vůči téměř všem plastifikovaným povrchům každodenního života, lakům (s výjimkou celulózových a šelakových ), akrylovým a glyceroftalovým barvám, přičemž je velmi dobrým rozpouštědlem. Díky tomu je široce používaným čisticím rozpouštědlem samotným nebo ve směsi s jinými sloučeninami.
Mísitelnost s vodou
Směsi vody a ethanolu zabírají objem menší než součet objemů obou složek, které se berou jednotlivě. Směs objemu vody a objemu ethanolu poskytuje například ekvivalentní objem 1,92. Reakce smíchání vody a ethanolu je exotermická a při 24,85 ° C může být uvolněno až 777 J mol -1 . Díky polární povaze ethanolu je hygroskopický natolik, že čistý absorbuje vlhkost ze vzduchu.
Azeotrop je tvořen vodou na 89.47 % mol ethanolu a 10,53 mol% vody, při atmosférickém tlaku . Bod varu ethanolu je 78,4 ° C a 100 ° C pro vodu, ale azeotrop se vaří při 78,2 ° C , což je nižší než teplota varu každé složky. Podíly azeotropické směsi se mění v závislosti na tlaku.
| Tlak | Bod varu | Molární frakce ethanolu |
|---|---|---|
| 0,1 MPa | 78,35 ° C | 0,894 |
| 0,344 MPa | 112,6 ° C | 0,882 |
| 0,689 MPa | 135,7 ° C | 0,874 |
| 1,378 MPa | 164,2 ° C | 0,862 |
| 2068 MPa | 182,6 ° C | 0,852 |
Přidání několika procent ethanolu do vody drasticky snižuje povrchové napětí vody. Tato vlastnost pomáhá vysvětlit fenomén slz vína . Při víření vína ve sklenici se ethanol rychle odpařuje v tenkém filmu po stranách sklenice. Podíl ethanolu klesá, takže se zvyšuje povrchové napětí a film se mění v kapičky. Tento jev se nazývá Marangoniho efekt a byl popsán a vysvětlen v roce 1855 Jamesem Thomsonem.
Alkoholu , také volal obsah alkoholu je poměr mezi objemem alkoholu obsaženého ve směsi a celkový objem směsi na 20 ° C . Používá se ke stanovení podílu alkoholu, tj. Ethanolu, v alkoholickém nápoji . Jednotkou použitou k vyjádření titru je objemový zlomek (% obj.) Nebo stupeň (uvedeno „°“).
Směsi voda-ethanol obsahující více než 50% ethanolu jsou hořlavé při pokojové teplotě , ale při zahřátí se může vznítit směs obsahující méně než 50% ethanolu. Tato vlastnost využívá techniku vaření. Alkohol přidaný na rozpálené pánvi hoří v plamenech a poskytuje složitou reakci. Teplota alkoholu, který hoří pak může překročit 240 ° C, a vede k karamelizaci z cukrů přítomných.
Výroba
Ethanol může být průmyslově z petrochemických podle hydratace z ethylenu , a alkoholovým kvašením z kvasinek nebo celulózy . Nejekonomičtější proces závisí hlavně na ropném trhu .
Přímá katalýza
Tento proces, vyvinutý v 70. letech, zcela nahradil další výrobní metody. Takto vyrobený ethanol se průmyslově používá jako surovina nebo jako rozpouštědlo . To se vyrábí petrochemie , pomocí hydratace od kyselé katalýzy z ethylenu , po reakci:
H 2 C = CH 2+ H 2 O↔ CH 3 CH 2 OHNejběžněji používaným katalyzátorem je kyselina fosforečná , adsorbovaná na porézním nosiči, jako je silikagel nebo celit . Zvýšení tlaku pomáhá posunout rovnováhu směrem k produkci ethanolu podle principu Le Chatelier , a proto je k rychlému dosažení rovnováhy použít katalyzátor pod vysokým tlakem vodní páry . Konečným produktem je směs vody a ethanolu obsahující 10 až 25 % ethanolu.
Nepřímá katalýza
Dřívější proces, ale nyní zastaralý, rozvinutý v 1930 od Union Carbide , a budou použity pro velkou část XX th století . Ethylenu je esterifikována pomocí kyseliny sírové, k výrobě ethyl-sulfát , který je pak hydrolyzován , čímž se získá ethanol a kyselinu sírovou, která tak slouží jako katalyzátor v této reakci:
H 2 C = CH 2+ H 2 SO 4→ CH 3 CH 2 SO 4 H CH 3 CH 2 SO 4 H+ H 2 O→ CH 3 CH 2 OH+ H 2 SO 4Tento proces spotřebovává velké množství kyseliny sírové a vyžaduje jako vstup kvalitní plynnou směs.
Kvašení
Ethanol používaný v alkoholických nápojích se vyrábí alkoholovým kvašením . Stejně tak většina bioethanolu pochází z fermentačního zpracování cukrových rostlin, jako je řepa a cukrová třtina , nebo obilovin, jako je kukuřice a pšenice . Některé druhy kvasinek , jako je Saccharomyces cerevisiae , metabolizují cukry na ethanol a oxid uhličitý po těchto reakcích:
C 6 H 12 O 6→ 2 CH 3 CH 2 OH+ 2 CO 2 C 12 H 22 O 11+ H 2 O→ 4 CH 3 CH 2 OH+ 4 CO 2Fermentace je kvasinky kultivovány za příznivých podmínek pro produkci alkoholu, při teplotě od asi 35 do 40 ° C . Nejodolnější kmeny kvasinek mohou přežít v koncentraci asi 15 % objemových ethanolu. Toxicita ethanolu kvasinek omezuje koncentraci alkoholu, který může být získán tím, vaření , a vyšší koncentrace mohou být získané mutage nebo destilací . Během fermentace se tvoří sekundární produkty, jako je glycerol , kyselina jantarová , kyselina octová a amylalkohol .
K výrobě ethanolu ze škrobu , například ze semen obilovin, je třeba jej nejprve přeměnit na cukry. Při vaření piva, semeno se nechá klíčit ( sladování ), který umožňuje produkci některých enzymů, jako je například cytases , amylázy , fosfatázy nebo peptidáz , nezbytných pro zcukernatění škrobu. U bioethanolu lze tento proces urychlit použitím kyseliny sírové nebo použitím amylázy vyrobené z hub.
Celulózový ethanol
Fermentace mohou být také získány z celulózy , ale až do nedávné doby cena celulázy , An enzym schopný se poškodí celulózy, nedovolil průmyslu vyvinout průmyslově. V roce 2004 postavila kanadská společnost Iogen Corporation první závod na výrobu ethanolu z celulózy. Vývoj této technologie by mohl umožnit využití a recyklaci mnoha rostlinných odpadů ze zemědělství obsahujících celulózu, jako jsou piliny nebo sláma . Další biotechnologické společnosti v současné době vyvíjejí houby schopné produkovat velké množství celulázy a xylanázy za účelem přeměny dalších zemědělských zbytků na celulózu, jako je kukuřičný odpad nebo bagasa z cukrové třtiny .
Čištění
Různé procesy výroby ethanolu produkují směsi voda-ethanol. Pro použití v průmyslu nebo jako palivo musí být ethanol čištěn. Frakční destilace může soustředit ethanolu 95,6 % objemových (89,5 mol% ), a který tvoří směs azeotropní s vodou, jejíž teplota varu je 78,2 ° C . Obvyklé způsoby získání absolutního ethanolu zahrnují použití vysoušedel , jako je škrob , glycerol nebo zeolity , azeotropická destilace a extrakční destilace .
Vlastnosti etanolu
K dispozici jsou různé druhy ethanolu pro různá použití:
- denaturovaný alkohol je obvykle ethanol, který se přidá k denaturační nevhodně směsi na spotřebu potravy. Použitými denaturačními činidly mohou být isopropylalkohol , methanol , diethylftalát , thiofen , diethylether nebo jiné kondenzáty zemního plynu . Používá se pro úklid, čištění, dezinfekci a v alkoholových kamnech . Rozpouštědlo pro šelakové laky pro truhláře , také odmašťovač v průmyslu, oceňovaný pro svou nízkou toxicitu pro pokožku. Obecně na 95 % objemových ;
- denaturovaný lihoviny je směs ethanolu a methanolu . Methylovaný alkohol je vysoce toxický kvůli přítomnosti methanolu (obvykle 5 až 10 % objemových ). Používá se k čištění oken a plastových povrchů;
- rektifikován je destilát měření od 70 do 96% objemových ethanolu za použití metody frakční destilaci . Maximální koncentrace, které lze dosáhnout destilací surového alkoholu, je 96 % objemových v důsledku tvorby azeotropu voda-ethanol. Používá se k výrobě likérů nebo vodky , ale také k údržbě, čištění nebo dezinfekci domácnosti;
- absolutní ethanol je ethanol s obsahem maximálně 1% vody, ale většina z hlavních dodavatelů v chemii prodávají pod pojmem absolutním ethanolu ethanolu 99,8%. Používá se jako rozpouštědlo pro laboratorní a průmyslové aplikace a jako palivo;
- bezvodý ethanol je ethanol, ze kterého byla co nejvíce odstraněna voda. Například reakce absolutního ethanolu s kovovým hořčíkem následovaná destilací za atmosférického tlaku produkuje ethanol při 50 ppm vody (0,005% hmotnostní vody nebo 1/20 000). Tento druh ethanolu umožňuje jeho použití v reakcích citlivých na vlhkost.
Reaktivita a reakce
Ethanol je primární alkohol a slabé kyseliny ( p K = 15,5), jejíž konjugovaná báze je ethanolát . Je to také dobrý nukleofil díky reaktivitě dubletů , které se neváží na kyslík. Jeho reaktivita, zejména v důsledku přítomnosti hydroxylové skupiny , může zahrnovat reakce dehydratace , dehydrogenace , oxidace a esterifikace .
Kyselinová chemie
Ethanol je neutrální molekula a pH roztoku ethanolu ve vodě je 7,00. Ethanol lze kvantitativně převést na svoji konjugovanou bázi , ethanolátový ion , reakcí s alkalickým kovem , jako je sodík :
2 CH 3 CH 2 OH+ 2 Na→ 2 CH 3 CH 2 ONa+ H 2nebo se silnou bází , jako je hydrid sodný :
CH 3 CH 2 OH+ NaH→ CH 3 CH 2 ONa+ H 2Esterifikace
Etanol reaguje s karboxylovými kyselinami v přítomnosti silné kyseliny ( katalýza ), čímž se získá ethyl estery a vody podle následující reakce:
RCOOH+ CH 3 CH 2 OH→ RCOOCH 2 CH 3+ H 2 OTato reakce je reverzibilní a rovnováhy se dosahuje pomalu, což vyžaduje použití kyselých katalyzátorů , jako je kyselina sírová , kyselina chlorovodíková , fluorid boritý nebo kyselina paratoluensulfonová . Aby se dosáhlo správných výtěžků, vyžaduje tato reakce, která se používá ve velkém průmyslu, odstranění vody z reakční směsi při jejím vzniku. Ethanol může také tvořit estery s anorganickými kyselinami, a umožňuje přípravu sloučenin široce používány v organické syntéze , jako je například diethyl-sulfát (C 2 H 5 ) 2 SO 4nebo triethylfosfát (C 2 H 5 ) 3 PO 4. Dusitan ethyl- CH 3 CH 2 O-N = Olze podobně připravit z ethanolu a dusitanu sodného a byl běžně používán jako diuretikum nebo lék na chřipku nebo nachlazení , než byl stažen z trhu počátkem 80. let .
K přípravě mýdel se používá zmýdelňovací reakce , která umožňuje reformovat ethanol z ethylesterů v přítomnosti kyseliny nebo báze za vzniku karboxylátu .
Dehydratace
Použití silných kyselin může umožnit dehydrataci ethanolu za vzniku diethyletheru a každý rok se za použití kyseliny sírové jako katalyzátoru vyrobí několik tun diethyletheru . Reakci lze popsat následovně:
2 CH 3 CH 2 OH→ CH 3 CH 2 OCH 2 CH 3+ H 2 O(při 120 ° C )Ethylenu je hlavní produkt, když teplota překročí 160 ° C :
CH 3 CH 2 OH→ H 2 C = CH 2+ H 2 OSpalování
Spalování etanolu je kouř a dává namodralý plamen. Spalovací reakce tvoří oxid uhličitý a vodní páru :
CH 3 CH 2 OH( l ) + 3 O 2( g ) → 2 CO 2( G ) + 3 H 2 O( G )Spalného tepla (Δ c H °) spalování etanolu je 1366,8 kJ mol -1 při 25 ° C , a specifická tepelná kapacita (C v ) je 2,438 kJ kg -1 K -1 .
Oxidace
Oxidace (nebo dehydrogenace ) ethanolu v přítomnosti katalyzátorů umožňuje získat ethanalu (nebo acetaldehyd ), v souladu s následující reakcí:
CH 3 CH 2 OH→ CH 3 CHO+ H 2V hepatocytů z jater , enzym alkoholdehydrogenáza podobně převede do ethanolu ethanalu. Ethanal je toxičtější než ethanol a může být zodpovědný za mnoho příznaků kocoviny , i když se během příznaků v krvi nevyskytuje. Alkohol dehydrogenáza má v mozku podružnou roli při přeměně ethanolu na ethanal a tuto reakci primárně katalyzuje enzym kataláza .
Konečné fáze alkoholové fermentace zahrnují přeměnu pyruvátu na ethanal pomocí enzymu pyruvát dekarboxylázy , následovanou redukcí (nebo hydrogenací ) ethanalu na ethanol pomocí enzymu alkohol dehydrogenázy , v tomto případě katalyzující opačnou reakci. Jako endogenní metabolit je ethanal toxický a je podezření na karcinogen. Poškozuje krvetvorné kmenové buňky (odpovědné za neustálou obnovu krve ); na jedné straně je to zdroj zlomů ve dvouvláknové DNA těchto buněk (což podporuje jejich úpadek a vytváří chromozomální přesmyky ) a na druhé straně brání správné opravě ( str. 53 ) tohoto poškození, které způsobuje malignity.
Halogenace
Etanol reaguje s halogeno-vodíkové kyseliny vyrábět halogenalkany , jako je například chlorethan a bromethanu , přes S N 2 reakce :
CH 3 CH 2 OH+ HCl→ CH 3 CH 2 Cl+ H 2 OTato reakce vyžaduje použití katalyzátoru , jako je chlorid zinečnatý . Tyto alkylhalogenidy mohou být také syntetizovány použitím halogenačních činidel , jako je thionylchlorid nebo bromid fosforitý :
CH 3 CH 2 OH+ SOCl 2→ CH 3 CH 2 Cl+ SO 2+ HClHaloformová reakce
Haloformová reakce je chemická reakce, která spočívá v syntetizovat trihalogenomethane , jako je například chloroform (CHCI 3), bromoform (CHBr 3) nebo jodoform (CHI 3), a je jednou z nejstarších organických reakcí popsaných jako takové. V roce 1822 , Georges Serullas hlášeny reakce ethanolu diodine a hydroxidem sodným ve vodě, tvořící mravenčan sodný a jodoform , pak se nazývá „uhlík-hydrojodid“.
Ethanol reaguje s chlornanem sodným za vzniku chloroformu podle následující syntézy:
CH 3 CH 2 OH+ NaClO→ CH 3 CHO+ NaCl+ H 2 O CH 3 CHO+ 3 NaOCl→ CCl 3 CHO+ 3 NaOH CCI 3 CHO+ NaOH→ CHCI 3+ HCO 2 NaPodobně se bromoform a jodoform získávají z hypobromitu sodného a hypojoditanu sodného. Ethanol je jediný primární alkohol, který umožňuje tuto reakci.
použití
Pohonné hmoty
Ethanol vyráběný po celém světě se používá hlavně jako palivo . Množství ethanolu se může pohybovat od několika procent v benzínu v západní Evropě po 95 % v benzinu v Brazílii , kde 90% nových vozidel používá techniku flex fuel a může na tuto směs běžet. Více než 66% ethanolu použitého jako palivo pochází z alkoholové fermentace .
Palivo E85 distribuované ve Francii obsahuje mezi 65% a 85% bioethanolu, zbytek tvoří benzín; míra se pohybuje mezi 65% a 75% v zimě a dosahuje 85% v létě.
V souvislosti s vodou to bylo palivo pro mnoho letadel ( spalovací motory ) a rakety během druhé světové války, pro země s omezenými ropnými zdroji.
Ve Francii je 1% půdy věnováno bioethanolu. Z osmnácti milionů hektolitrů vyrobených ve Francii ročně se dvanáct milionů používá na výrobu biopaliv, z nichž 30% se prodává mimo Francii. Z osmi milionů hektolitrů bioethanolu určených pro biopaliva ve Francii se jeden milion (neboli 12%) používá v palivu E85 . Malé množství ethanolu se také používá k výrobě ED95 (95% bioethanolu a 5% přísady proketanu) pro specificky motorová těžká nákladní vozidla (včetně autobusů a autokarů).
Alkoholické nápoje
Obsah ethanolu (nebo stupeň alkoholu ) v alkoholických nápojích se liší v závislosti na způsobu výroby a surovině. Většina alkoholických nápojů může být rozdělena mezi fermentované nápoje a lihoviny . Mezi hlavní kvašené nápoje jsou pivo , vyrobené z obilnin nebo jiných rostlin produkujících škrob , vína a mošty , vyráběné z ovocné šťávy a medovinu , vyrobený z medu . Tyto lihoviny se vyrábí destilací kvašené nápoje . Můžeme rozlišit různé druhy lihovin , jako je whisky , destilovaná ze semen fermentovaných obilovin, eaux-de-vie , destilovaná z fermentované ovocné šťávy nebo rum , destilovaná z melasy nebo šťávy z cukrové třtiny . Mnoho eaux-de-vie a likérů se také připravuje nalitím ovoce, bylin a koření do lihovin , jako je gin, který se vyrábí nalitím bobulí jalovce do rektifikovaného alkoholu .
Jiné metody mohou být použity ke zvýšení hladiny alkoholu , jako je například frakční tuhnutí , které se používají pro výrobu applejack z jablečné šťávy. Alkoholizované víno se připraví přidáním do života ve vodě o- nebo jiných lihovin do částečně zkvašeného vína, přičemž tento způsob zabíjení kvasinky při zachování některých cukrů.
Alkoholické nápoje se používají při vaření pro svou vůni a protože alkohol rozpouští hydrofobní pachové sloučeniny . Ethanol z těchto nápojů se také používá k výrobě octa , stejně jako se průmyslový ethanol používá k výrobě kyseliny octové .
Surovina
Ethanol je důležitým syntetickým meziproduktem v chemickém průmyslu . Používá se zejména při přípravě ethyl halogenidů , ethyl estery, ethyl aminy , diethylether , kyseliny octové , a v menší míře butadienu .
Antiseptický
Ethanol se používá v lékařství v kompresích jako antiseptikum . Používá se také v hydroalkoholických roztocích v koncentraci asi 60 % objemových . Ethanol zabíjí organismy denaturací jejich proteinů a rozpouštěním jejich lipidů. Je účinný proti většině bakterií a plísní , mnoha virům , ale neúčinný proti sporům .
Solventní
Ethanol je mísitelný s vodou a je dobrým rozpouštědlem . Najdete jej v barvách , průmyslových odstínech, tradičních lacích, alkoholických nápojích , značkovačích a v kosmetice, jako jsou parfémy a deodoranty .
Lékařské použití
Absolutního ethanolu se někdy vstřikuje do nádorů za účelem vyvolání jejich odumření . Nemá však cílenou aktivitu, protože bez rozdílu způsobuje nekrózu zdravých a rakovinných tkání.
Ethanol se také používá k léčbě otravy metanolem nebo ethylenglykolem . V těchto případech soutěží ethanol s jinými alkoholy, které mají být metabolizovány enzymem alkohol dehydrogenázou , čímž redukuje toxické deriváty, které vznikají při jejich metabolizaci na aldehydy a karboxylové kyseliny , a snižuje toxické účinky v důsledku krystalizace šťavelanu vápenatého (z ethylenglykolu). ) v ledvinách .
Historické využití
Před vývojem moderních léků byl ethanol používán k různým lékařským účelům, včetně léčby deprese a jako anestetikum . Je také známo, že může sloužit jako sérum pravdy .
Jako palivo se používal v raketových motorech kombinovaných s kapalným kyslíkem . Během druhé světové války německá raketa „ V2 “ používala ke snížení teploty spalovací komory ethanol smíchaný s 25 % obj. Vody . Americký „ PGM-11 Redstone “ balistické střely , vycházející z designu německého V2, používá ethanolu ve směsi s kapalným kyslíkem . Alkoholická paliva pro rakety a rakety následně přestala být používána při vývoji nových paliv.
Farmakologie
Dvěma hlavními cestami metabolismu ethanolu v játrech jsou alkohol dehydrogenáza a oxidační systém, mikrosomální ethanol (in) . Při nízkých koncentracích ethanolu alkoholdehydrogenáza oxiduje ethanol na acetaldehyd , ale při vyšších koncentracích nebo při opakovaných dávkách ethanolu převládá mikrosomální oxidační systém ethanolu.
V Evropském lékopisu označuje „ethanol“ bezvodý ethanol, to znamená 100% čistý, na rozdíl od 95 % objemových nebo 70 % objemových ethanolu, které lze nalézt v lékárnách . K tomu se přidává kvalitní „alkohol Ph. Eur. „(Pro Evropský lékopis ), který označuje jakost ethanolu, pro kterou byly kvantifikovány četné stopy a nečistoty.
Fyziologické vlastnosti
Příjem alkoholu má různé účinky, přičemž alkoholem je nadměrná konzumace nápojů obsahujících ethanol, která je návyková a řadí se mezi etanol. Pro společnosti by to byla nejškodlivější droga.
| Hladina alkoholu v krvi ( g · l –1 ) |
Obsah alkoholu ( % obj. ) |
Příznaky |
|---|---|---|
| 0,5 | 0,05 | Euforie, relaxace |
| 1.0 | 0,1 | Deprese, nevolnost, zvracení, snížené smyslové a motorické schopnosti, zpomalené poznávání |
| > 1.4 | > 0,14 | Snížený průtok krve do mozku |
| 3.0 | 0,3 | Ztráta vědomí |
| 4.0 | 0,4 | Možná smrt |
| 5.5 | 0,55 | Smrt |
Hladina alkoholu v krvi
BAC je množství ethanolu v krvi; obvykle se vyjadřuje v gramech na litr krve. Hladina alkoholu v krvi vyšší než 4,0 g L −1 může být smrtelná a hladina se stává smrtelnou nad 5,5 g L −1 . Nízké dávky ethanolu, pod 0,5 g L −1 , způsobují pocit euforie , lidé jsou více upovídaní, méně potlačovaní a vykazují snížené analytické schopnosti. Při vyšších dávkách, nad 1,0 g L −1 , působí ethanol jako tlumivo na centrální nervový systém , příznaky zahrnují zpomalené poznávání , sníženou smyslovou a motorickou funkci, ztrátu vědomí až do smrti.
Účinky na centrální nervový systém
Ethanol je depresivní z centrálního nervového systému a je považován za lék psychotropní . Působí na centrální nervový systém interakcí hlavně s receptory GABA A , čímž zvyšuje inhibiční účinek neurotransmiteru kyseliny y-aminomáselné (nebo GABA). GABA zpomaluje aktivitu neuronů (na rozdíl od glutamátu, který je urychlovačem informací); vazbou na receptory GABA tedy ethanol zveličuje zpomalení mozku . Působí proto jako pozitivní alosterický modulátor . Ethanol také působí na receptory serotoninu , glutamátu , acetylcholinu a dopaminu . Jeho negativní účinky mohou být zesíleny olovem, které zvyšuje oxidační stres . Olovo zesiluje účinek alkoholu na centrální nervový systém (CNS).
Dlouhodobá konzumace ethanolu proto může způsobit trvalé poškození mozku a dalších orgánů. Odnětí alkoholu může vyvolat různé příznaky, jako jsou poruchy pozornosti , zvýšené pocení, tachykardie , třes (třes končetin), někdy nevolnost nebo zvracení, dehydratace, malátnost , na hypertenze . Někdy je doprovázen záchvatem epilepsie , zrakovými, hmatovými nebo sluchovými halucinacemi, jedná se o delirium tremens v nejtěžší formě. Nakonec a ve vzácných případech se může objevit bolest od čelisti k lebce. Bylo také prokázáno, že etanol způsobuje změny ve velikosti šedé hmoty viditelné pouhým okem .
Účinky na metabolismus
Jako takový je ethanol živinou . V lidském těle je metabolizován na acetaldehyd enzymem alkohol dehydrogenáza . Acetaldehyd se následně převede acetaldehyddehydrogenázou na acetyl-koenzym A , který je konečným produktem metabolismu sacharidů a lipidů . Samotný acetaldehyd je však mnohem toxičtější než ethanol a je částečně zodpovědný za většinu klinických účinků alkoholu, jako jsou kocoviny . Zejména bylo prokázáno, že zvyšují riziko cirhózy v játrech a je spojeno s mnoha forem rakoviny .
Dlouhodobé účinky
Ethanol je klasifikován jako teratogenní činidlo , a může vyvolat fetální alkoholový syndrom , který je alkohol otravy z embrya nebo plodu v důsledku konzumace matky alkoholu během těhotenství , a která narušuje vývoj orgány.
Pravidelná konzumace alkoholu je také faktorem, který přispívá ke zvýšení triglyceridů v krvi, což podporuje výskyt kardiovaskulárních onemocnění .
Ethanol v alkoholických nápojích je považován za jednoznačný karcinogen, a proto je jedním z karcinogenů skupiny IARC skupiny 1 .
Lékové interakce
Ethanol může zvyšovat útlum způsobený depresory působícími na centrální nervový systém , jako jsou barbituráty , benzodiazepiny , opioidy , fenothiaziny a antidepresiva .
Poznámky a odkazy
- (fr) Tento článek je částečně nebo zcela převzat z anglického článku Wikipedie s názvem „ Ethanol “ ( viz seznam autorů ) .
- ETHANOL (ANHYDRO) , bezpečnostní list (y) Mezinárodního programu pro chemickou bezpečnost , konzultováno 9. května 2009
- (in) Y. Marcus , The Properties of Solvents , Chichester, Anglie, John Wiley & Sons , al. "Řešení Chemie" ( n O 4),1998, 254 s. ( ISBN 978-0-471-98369-9 a 0471983691 , LCCN 98018212 , online prezentace ) , s. 95
- Marcus, 1998 , str. 88.
- vypočtená molekulová hmotnost od „ atomové hmotnosti prvků 2007 “ na www.chem.qmul.ac.uk .
- (in) James E. Mark, Fyzikální vlastnosti příručky pro polymery , Springer,2007, 2 nd ed. , 1076 str. ( ISBN 978-0-387-69002-5 a 0-387-69002-6 , číst online ) , s. 294
- (in) Serban Moldoveanu, Příprava vzorku v chromatografii , Amsterdam / Boston, Elsevier ,2002, 930 s. ( ISBN 0-444-50394-3 ) , s. 258
- „ Toxikologický list FT 48 - Ethanol “ , na webových stránkách Národního ústavu pro výzkum a bezpečnost pro prevenci pracovních úrazů a nemocí z povolání ,2011(zpřístupněno 14. května 2012 ) .
- (in) RH Perry a DW Green , Příručka Perryho chemického inženýra , McGraw-Hill ,1997, 7 th ed. , 2640 s. ( ISBN 978-0-07-049841-9 , LCCN 96051648 ) , s. 2-50.
- (in) CA Faúndez a OJ Valderrama , „ Modely koeficientu aktivity k popisu rovnováhy par a kapalin v ternárních hydroalkoholických roztocích “ , Chin. J. Chem. Eng. , sv. 17, n O 2dubna 2009, str. 259-267 ( ISSN 1004-9541 , DOI 10,1016 / S1004-9541 (08) 60203-7 )
- (in) William M. Haynes , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press / Taylor and Francis,1 st 07. 2010, 91 th ed. , 2610 s. ( ISBN 9781439820773 , online prezentace ) , s. 14-40
- (in) O. Haida , H. Suga et al. , „ Studie Kalorimetrické ze skelného stavu XII. Množství jevů skelného přechodu ethanolu “ , J. Chem. Termodynamika. , sv. 9, n o 12,Prosince 1977, str. 1133–1148 ( ISSN 0021-9614 , DOI 10.1016 / 0021-9614 (77) 90115-X ).
- (in) J. Chao a FD Rossini , „ Teplo spalování, trénink a izomerizace alkanolů devatenáct “ , J. Chem. Eng. Data , roč. 10, n O 4,1965, str. 374-379 ( ISSN 0021 - 9568 , DOI 10,1021 / je60027a022 ).
- (in) Carl L. Yaws, Příručka termodynamických diagramů: Organické sloučeniny C8 až C28 , sv. 1, Huston, Texas, Gulf Pub. Co.,1996, 396 s. ( ISBN 978-0-88415-857-8 , LCCN 96036328 )
- (in) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18. června 2002, 83 th ed. , 2664 s. ( ISBN 0849304830 , online prezentace ) , s. 5-89
- (in) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press / Taylor and Francis,17. června 2008, 89 th ed. , 2736 str. ( ISBN 9781420066791 , online prezentace ) , s. 10-205
- „ Ethanol “ na adrese reciprocalnet.org (přístup 12. prosince 2009 )
- [1]
- Pracovní skupina IARC pro hodnocení karcinogenních rizik pro člověka, „ Globální hodnocení karcinogenity pro člověka, skupina 1: Karcinogenita pro člověka “ , na http://monographs.iarc.fr , IARC,16. ledna 2009(zpřístupněno 22. srpna 2009 )
- Bezpečnostní list poskytnutý společností Sigma-Aldrich, konzultován 28. 9. 2019
- „ Ethylalkohol “ na adrese hazmap.nlm.nih.gov (přístup k 14. listopadu 2009 )
- „ ESIS “ (zpřístupněno 6. prosince 2008 )
- (in) GP Moss ( eds. ), „ Základní terminologie stereochemie “ , Pure Appl. Chem. , IUPAC , roč. 68, N O 121996, str. 2193-2222 ( ISSN 0033-4545 a 1365-3075 , DOI 10.1351 / pac199668122193 ).
- (en) PE McGovern , J. Zhang a kol. , „ Kvašené nápoje z pre- a proto-historická Číně “ , Proc. Natl. Acad. Sci. USA , roč. 101, n o 51,21. prosince 2004, str. 17593-17598 ( ISSN 0027-8424 , PMID 15590771 , PMCID PMC539767 , DOI 10.1073 / pnas.0407921102 , číst online ).
- (en) RJ Forbes , Krátká historie umění destilace: Od počátků až po smrt Celliera Blumenthala , Leiden, Nizozemsko, Brill ,1970, 2 nd ed. ( 1 st ed. 1948), 405 str. ( ISBN 978-90-04-00617-1 , online prezentace , číst online ) , s. 89.
- " Mohammad Ibn Zakariâ Râzi (865-925), nejvýznamnější doktor islámské civilizace - La Revue de Téhéran | Írán “ , na www.teheran.ir (přístup 9. července 2016 )
- (in) „ Alkohol “ , na stránkách Encyclopaedia Britannica ,1911(zpřístupněno 12. května 2012 ) .
- (in) AS Cut , „ was New Chemical Theory “ , Philos. Mag. , 4 th série, vol. 16,1858, str. 104-116 ( ISSN 1478-6435 , číst online ).
- (in) H. Hennell , „ O vzájemném působení kyseliny sírové a alkoholu, s poznámkami o složení a vlastnostech výsledné sloučeniny “ , Philos. Trans. R. Soc. , sv. 116,9. března 1826, str. 240-249 ( DOI 10.1098 / rstl.1826.0021 , číst online ).
- (in) Joseph DiPardo, „ Výhled na výrobu a poptávku po etanolu z biomasy “ , o správě energetických informací (zpřístupněno 14. května 2012 )
- (in) VD Hunt , The gasohol handbook , New York Industrial Press,devatenáct osmdesát jedna, 580 s. ( ISBN 978-0-8311-1137-3 , online prezentace ).
- (in) R. Dudley , „ Zrání etanolového ovoce a historické počátky alkoholu v primitivním alkoholismu ve zlomyslnosti “ , Integr. Comp. Biol. , sv. 44, n O 4,2004, str. 315-323 ( ISSN 1540-7063 , DOI 10.1093 / icb / 44.4.315 ).
- Kreuzwieser J, Papadopoulou E & Rennenberg H (2004) Interaction of flododing with uhlíkový metabolismus lesních stromů , Plant Biol., 6, 299–306, 2004
- Kimmerer TW & MacDonald RC (1987) Acetaldehyd a biosyntéza ethanolu v listech rostlin , Plant Physiol., 84, 1204–1209
- (in) S. Leblová E. Sineckáet et al. , „ Metabolismus Pyruvát v klíčících semenech během přirozené anaerobní “ , Biol. Plantarum , sv. 16, n O 6,1974, str. 406-411 ( ISSN 0006-3134 , DOI 10.1007 / BF02922229 ).
- Kirstine WV & Galbally IE (2011) Globální rozpočet na atmosférický rozpočet byl znovu navštíven ; Atmosférická chemie a fyzika 11 (1): 25909-25936 | Září | DOI: 10.5194 / acpd-11-25909-2011
- (in) A. Schriver , L. Schriver-Mazzuoli a kol. , „ Jeden možný původ etanolu v mezihvězdném: Fotochemie smíšené CO 2 -C 2 H 6 filmy v 11 studie K. FTIR “ , Chem. Phys. , sv. 334, n bone 1-3,2007, str. 128–137 ( DOI 10.1016 / j.chemphys.2007.02.018 ).
- (en) M. Windholz ( ed. ), The Merck Index: An Encyclopedia of Chemicals and Drugs , sv. 9, Merck ,1976, 9 th ed. , 1835 s. ( ISBN 978-0-911910-26-1 ).
- (en) U. Dahlmann a GM Schneider , „ (kapalina + kapalina) fáze rovnováhy a kritické křivky (ethanol + dodekan nebo hexadekan tetradekanové zlato nebo 2,2,4,4,6,8,8-heptamethylnonan) z 0, 1 MPa až 120,0 MPa “ , J. Chem. Termodynamika. , sv. 21, n o 9,Září 1989, str. 997–1004 ( ISSN 0021-9614 , DOI 10.1016 / 0021-9614 (89) 90160-2 ).
- (in) C. Reichardt a T. Welton , Rozpouštědla a účinky rozpouštědel v organické chemii , Weinheim, Wiley-VCH ,2010, 4 th ed. , 692 s. ( ISBN 978-3-527-32473-6 , DOI 10.1002 / 9783527632220 , online prezentace ) , „Dodatek“ , s. 1 568.
- (en) JE Logsdon , Kirk-Othmer Encyclopedia of Chemical Technology , John Wiley & Sons ,2004( ISBN 978-0-471-23896-6 , DOI 10.1002 / 0471238961.0520080112150719.a01.pub2 , číst online ) , „Ethanol“.
- (en) MJ Costigan , LJ Hodges et al. , „ Izotermická výtlak kalorimetr: Konstrukční úpravy pro měření exotermní entalpie míšení “ , Aust. J. Chem. , sv. 33, n o 10,1980, str. 2103-2119 ( ISSN 0004-9425 , DOI 10.1071 / CH9802103 ).
- (in) RW Rousseau , Handbook of Separation Process Technology , John Wiley & Sons ,1987, 1010 str. ( ISBN 978-0-471-89558-9 , číst online ) , s. 261–262.
- J. Vidal , Termodynamika: aplikace v chemickém inženýrství a v ropném průmyslu , Paříž, Éditions Technip ,1997, 500 s. ( ISBN 978-2-7108-0715-5 , LCCN 97194455 , číst online ) , s. 181.
- (in) J. Thomson , „ jsou některé zvědavé pohyby pozorovatelné na povrchu vína a jiných alkoholických likérů “ , Philos. Mag. , sv. 10,1855, str. 330-333 ( číst online ).
- (en) GA Mills a EE Ecklund , „ Alkoholy jako složky pohonných hmot v dopravě “ , Annu. Rev. Energie Přibl. , sv. 12,Listopad 1987, str. 47-80 ( DOI 10.1146 / annurev. Např. 12.110187.000403 ) .
- (en) PB Morais , CA Rosa a kol. , „ Výrobu palivových alkoholu Saccharomyces kmenů z tropických stanoviště “ , Biotechnol. Lett , sv. 18, n o 11,1996, str. 1351-1356 ( ISSN 0141-5492 , DOI 10.1007 / BF00129969 ).
- (in) PC Badger , J. Janick ( ed. ) A A. Whipkey ( eds. ), Trendy v nových plodinách a nových použitích , Alexandria, VA, ASHS Press,2002, 599 s. ( ISBN 978-0-09-707565-5 , číst online ) , „Ethanol z celulózy: Obecný přehled“ , s. 17–21.
- (in) MJ Taherzadeh a K. Karimi , „ Procesy hydrolýzy etanolu z lignocelulózových materiálů na bázi kyselin: přehled “ , BioRes. , sv. 2 n o 3,2007, str. 472-499 ( ISSN 1930-2126 , číst online ).
- (in) MJ Taherzadeh a K. Karimi , „ Procesy hydrolýzy ethanolu z lignocelulózových materiálů na bázi enzymu: Přehled “ , BioRes. , sv. 2, n O 4,2007, str. 707-738 ( ISSN 1930-2126 , číst online ).
- (in) SK Ritter , „ Výboj zlata z biomasy: Technologie využívající cukry z rostlin k výrobě chemických surovin je připravena a čeká ... “ , Chem. Eng. Novinky , roč. 82, n o 22,Květen 2004, str. 31-34 ( ISSN 0009-2347 , číst online ).
- (in) „ Brew Better Ethanol “ na Popular Science Online ,2006(zpřístupněno 18. května 2012 ) .
- (in) DR Lide ( eds. ), CRC Handbook of Chemistry and Physics , Boca Raton, FL, CRC Press ,2007, 88 th ed. , 2640 s. ( ISBN 978-0-8493-0488-0 ) , kap. 8 („Analytical Chemistry“) , s. 8 42.
- (in) HD Hinton a JA Nieuwland , „ Organic Reactions with Boron Fluoride. I. Příprava esterů “ , J. Am. Chem. Soc. , sv. 54, n o 5,1932, str. 2017–2018 ( ISSN 0002-7863 , DOI 10.1021 / ja01344a046 ).
- (in) „ Historie tvorby pravidel pro OTC sladké destiláty léčivých přípravků Nitre “ o správě potravin a léčiv (zpřístupněno 22. května 2012 ) .
- (in) K. Schumann a K. Siekmann , Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH Verlag ,2000( ISBN 978-3-527-30673-2 , online prezentace ) , „Mýdla“.
- Lide, 2007 , kap. 5 („Termochemie, elektrochemie a kinetika“), s. 5 70.
- Lide, 2007 , kap. 15 („Praktická laboratorní data“), s. 15 17 .
- (v), R. Swift a D. Davidson , " alkohol Hangover: přístroje a mediátory " , Alcohol Health Res. W. , sv. 22, n o 1,1998, str. 54-60 ( číst online ).
- (in) L. Hipolito , J. Sanchez a kol. , „ Brain Metabolismus ethanolu a alkoholismus: aktualizace “ , Curr. Drug Metab , sv. 8, n o 7,října 2007, str. 716-727 ( ISSN 1389-2002 , PMID 17979660 , DOI 10.2174 / 138920007782109797 ).
- (pdf) Toxikologický list č. 120 od INRS, konzultován 24. června 2017
- Juan I. Garaycoechea a spol. (2018) Alkohol a endogenní aldehydy poškozují chromozomy a mutují kmenové buňky | Příroda | doi: 10.1038 / nature25154 | publikováno online 3. ledna 2018 | abstraktní
- (in) L. Kurti a B. Czako , Strategické aplikace pojmenovaných reakcí v organické syntéze , Academic Press ,2005, 864 s. ( ISBN 978-0-12-369483-6 , online prezentace ) , s. 264-265.
- GS Serullas , „ Jodovodík . Zvláštní okolnosti, za kterých k této trojkombinaci došlo; způsob jeho okamžité výroby, “ Annal. Chim. Phys. , sv. 20,Květen 1822, str. 17–37 ( číst online ).
- " Poslední změna superethanol E85..N645843 " , na usinenouvelle.com .
- (in) G. McDonnell a AD Russell , „ Antiseptika a dezinfekční prostředky: aktivita, akce a rezistence “ , Clin. Microbiol. Rev. , sv. 12, n o 1,1999, str. 147–179 ( ISSN 0893-8512 , PMCID PMC88911 , číst online [PDF] ).
- (en) DG Barceloux , GR Bond a kol. , „ American Academy of Clinical toxikologie doporučených postupů na léčbu methylalkoholu otravy “ , Clin. Toxicol. , sv. 40, n O 4,2002, str. 415-446 ( DOI 10.1081 / CLT-120006745 ).
- (in) YB Shvets , stanice Washington: Můj život špióna KGB v Americe , New York, Simon & Schuster ,1995, 298 s. ( ISBN 978-0-671-88397-3 ).
- (in) „ V2 “ o raketových a vesmírných technologiích (zpřístupněno 27. května 2012 ) .
- (in) „ Rocket Propellants “ , v The Internet Encyclopedia of Science (přístup 27. května 2012 ) .
- (in) „ Stručná historie raketové techniky “ v Kennedyho vesmírném středisku (přístup 27. května 2012 ) .
- (in) LA Pohorecký a J. Brick , „ Pharmacology of Ethanol “ , Pharmacol. Ther. , sv. 36, n kost 2-3,1988, str. 335–427 ( ISSN 0163-7258 , PMID 3279433 , DOI 10.1016 / 0163-7258 (88) 90109-X ).
- (in) „ Ethanolum anhydricum “ na Evropském ředitelství pro kvalitu léčivých přípravků (přístup ke dni 28. května 2012 ) .
- (in) DJ Nutt , THE King et al. , „ Škodách spojených s drogami ve Velké Británii: analýza rozhodnutí multicriteria “ , Lancet , sv. 376, n O 9752,6. listopadu 2010, str. 1558-1565 ( ISSN 0140-6736 , DOI 10.1016 / S0140-6736 (10) 61462-6 ).
- (en) DA Yost , „ Akutní péče o intoxikaci alkoholem. Být připraven zvážit klinické dilema “ , Postgrad Med. , sv. 112, n O 6,2002, str. 14-26 ( ISSN 0032-5481 , PMID 12510444 , DOI 10,3810 / pgm.2002.12.1361 ).
- (in) V. Santhakumar , pan Wallner a kol. , „ Ethanol působí přímo na extrasynaptickým podtypy GABA A receptoru pro zvýšení tonikum inhibice “ , alkohol , sv. 41, n o 3,Květen 2007, str. 211–221 ( ISSN 0741-8329 , PMID 17591544 , PMCID PMC2040048 , DOI 10.1016 / j.alkohol.2007.04.011 , číst online ).
- Virgolini, MB, Mattalloni, MS, Deza-Ponzio, R., Albrecht, PA, & Cancela, LM (2019). Expozice olovu a příjem etanolu: oxidační stres jako konvergující mechanismus účinku . In Neuroscience of Alcohol (str. 515-525). Akademický tisk ( abstrakt ).
- (en) Fein G, D Greenstein, Cardenas VA, Cuzen NL, Stein DJ a kol. , „ Kortikální a subkortikální objemy dospívajících s závislosti na alkoholu, ale bez látky nebo psychiatrických komorbidit “ , Psychiatry Res , vol. 214, n o 1,2013, str. 1-8. ( PMID 23916536 , PMCID PMC4203651 , DOI 10.1016 / j.pscychresns.2013.06.001 , číst online [html] )
- (in) Little G, P Maurage, Kornreich C Verbanck P, S Campanella, „ Nárazové pití u dospívajících: přehled neurofyziologického a neuroimagingového výzkumu “ , Alkohol Alkohol , sv. 49, n O 22014, str. 198-206. ( PMID 24302160 , DOI 10.1093 / alcalc / agt172 , číst online [html] )
- (en) K. Nakamura , K. Iwahashi a kol. , „ Acetaldehyd adukty v mozku alkoholiků “ , Arch. Toxicol. , sv. 77, n o 10,2003, str. 591-593 ( ISSN 0340-5761 , DOI 10.1007 / s00204-003-0465-8 ).
Podívejte se také
Bibliografie
- (en) JE Logsdon , Kirk-Othmer Encyclopedia of Chemical Technology , John Wiley & Sons ,2004( ISBN 978-0-471-23896-6 , DOI 10.1002 / 0471238961.0520080112150719.a01.pub2 , číst online ) , „Ethanol“.
- (en) LA Pohorecký a J. Brick , „ Farmakologie ethanolu “ , Pharmacol. Ther. , sv. 36, n kost 2-3,1988, str. 335–427 ( ISSN 0163-7258 , PMID 3279433 , DOI 10.1016 / 0163-7258 (88) 90109-X ).
Související články
- Jiné alkoholy: Alkohol , Primární alkohol , Metanol , Propanol a Butanol
- Vlastnosti: Absolutní alkohol , metylalkohol , denaturovaný alkohol a alkohol rektifikovaný
- Výroba: Alkoholické kvašení , Celulózový ethanol
- Použití: Alkohol , Bioethanol , Alkoholický nápoj , Lihoviny , Alkoholický průmysl
- Historie: Historie piva , Historie vinné révy a vína
- Fyziologické vlastnosti: Alkohol dehydrogenáza , Alkoholemie , Alkoholismus , Kocovina , Intoxikace alkoholem , Fetální alkoholový syndrom
- Různé: Výpočet titulů s alkoholem a objemů , stupeň alkoholu , Tears vína , Alkoholické macerace










