n- butyllithium
| n- butyllithium | |||
| |||
|
| |||
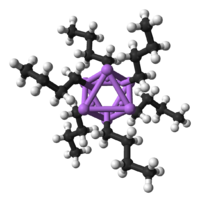
| 3D model na hexamer z n -butyllithia (nahoře) a rovinné vzorcem n -butyllithia (dole). | |||
| Identifikace | |||
|---|---|---|---|
| Název IUPAC |
Butyllithium, Tetra-μ 3 -butyl-tetralithium |
||
| Synonyma |
BuLi |
||
| N O CAS | |||
| Ne o ECHA | 100 003 363 | ||
| Ne o EC | 203-698-7 | ||
| PubChem | 61028 | ||
| ChEBI | 51469 | ||
| ÚSMĚVY |
[Li +]. CCC [CH2-] , |
||
| InChI |
Std. InChI: InChI = 1S / C4H9.Li / c1-3-4-2; / h1,3-4H2,2H3; / q-1; +1 standardní InChIKey: DLEDOFVPSDKWEF-UHFFFAOYSA-N |
||
| Vzhled | bezbarvá krystalická pevná látka , nestabilní a obvykle se získá jako slabě žlutý roztok | ||
| Chemické vlastnosti | |||
| Hrubý vzorec |
C 4 H 9 Li [izomery] |
||
| Molární hmotnost | 64,055 ± 0,006 g / mol C 75%, H 14,16%, Li 10,84%, |
||
| Fyzikální vlastnosti | |||
| T. fúze | -95 ° C (15% roztok v hexanu ) | ||
| T ° vroucí | 69 ° C (15% roztok v hexanu) | ||
| Rozpustnost | prudký rozklad ve vodě, rozpustný v etheru , THF , cyklohexanu . Prudce reaguje s protickými rozpouštědly a chlorovanými rozpouštědly. |
||
| Objemová hmotnost | 0,68 g · cm -3 (15% roztok v hexanu, 20 ° C ) | ||
| Teplota samovznícení | 240 ° C (15% roztok v hexanu) | ||
| Bod vzplanutí | -22 ° C (roztok 2,5 mol · L -1 v hexanech) | ||
| Meze výbušnosti ve vzduchu | LEL = 1,2% objem. ; LSE = 7,8% obj. (15% roztok v hexanu) | ||
| Tlak nasycených par | 16,3 kPa (15% roztok v hexanu, 20 ° C ) | ||
| Opatření | |||
| SGH | |||
     Nebezpečí H225, H250, H304, H314, H336, H361, H373, H411, P210, P222, P231, P261, P273, P422, H225 : Vysoce hořlavá kapalina a páry H250 : Vznítí se spontánně při kontaktu se vzduchem H304 : Při požití a vniknutí do dýchacích cest může způsobit smrt H314 : Způsobuje těžké poleptání kůže a poškození očí H336 : Může způsobit ospalost nebo závratě H361 : Podezření na poškození plodnosti nebo nenarozených dětí dítě (uveďte účinek, pokud je znám) (uveďte cestu expozice, je-li přesvědčivě prokázáno, že žádná jiná cesta expozice nevede ke stejnému nebezpečí) H373 : Může způsobit poškození orgánů (uveďte všechny postižené orgány, jsou-li známy), po opakované expozici nebo dlouhodobá expozice (uveďte cestu expozice, je přesvědčivě prokázáno, že žádná jiná cesta expozice nezpůsobuje stejné nebezpečí) H411 : Toxický pro vodní organismy, s dlouhodobými účinky P210 : Chraňte před teplem / jiskrami / otevřeným plamenem / horkými povrchy. - Kouření zakázáno. P222 : Nenechávejte ve styku se vzduchem. P231 : Zacházejte pod inertním plynem. P261 : Zamezte vdechování prachu / dýmu / plynu / mlhy / par / aerosolů. P273 : Zabraňte uvolnění do životního prostředí. P422 : Ukládat obsah pod ... |
|||
| WHMIS | |||
 B6, B6 : Reaktivní hořlavý materiál spontánně hořlavý při kontaktu se vzduchem; se stane spontánně hořlavým při kontaktu s vodou Zveřejnění na 1,0% podle klasifikačních kritérií |
|||
| Doprava | |||
Kemlerův kód: X333 : samozápalná kapalná látka, která nebezpečně reaguje s vodou. UN číslo : 3394 : ORGANOMETALICKÁ LÁTKA PYROFORICKÁ KAPALINA, VODĚ REAKTIVNÍ Štítky: 4.2 : Látky podléhající samovznícení 4.3 : Látky, které při styku s vodou uvolňují hořlavé plyny Balení: Obalová skupina I : velmi nebezpečné zboží ;   |
|||
| Související sloučeniny | |||
| Izomer (y) | t- BuLi , s- BuLi | ||
| Jednotky SI a STP, pokud není uvedeno jinak. | |||
N -butyllithium , abstraktní n -BuLi , je chemická sloučenina podle vzorce Lich 2 -CH 2 -CH 2 -CH 3, Izomer z sec -butyllithium a terc -butyllithium . Je to nejpoužívanější organolithné činidlo . Je široce používán jako iniciátor pro polymeraci při výrobě elastomerů, jako je polybutadien (BR) nebo styren-butadien-styren (SBS), a jako silná báze ( superbáza ) v organické syntéze , jak v průmyslovém měřítku, laboratoře.
Roztok n- butyllithia je dostupný v obchodě (15%, 20%, 23%, 24%, 25%, 2 M , 2,5 M, 10 M atd. ) V uhlovodíku ( pentan , hexan , cyklohexan , heptan , toluen ) ale ne v etherech, jako je diethylether a tetrahydrofuran (THF), protože s nimi reaguje při teplotě místnosti. Roční celosvětová produkce a spotřeba n- butyllithia je přibližně 900 tun.
I když je to bezbarvá pevná látka, n- butyllithium se obecně vyskytuje jako roztok, světle žlutý v alkanech . Taková řešení jsou neomezeně stabilní, pokud jsou správně uložena, ale v praxi se postupně zhoršují; usadí se jemná bílá sraženina hydroxidu lithného LiOH a barva se změní na oranžovou.
Struktura a spojení
N -BuLi se ve formě shluku v pevném stavu a v roztoku ve většině rozpouštědel. Tato tendence k agregaci je společná pro organolithné sloučeniny . Tyto agregáty jsou udržovány kompaktní kovalentními vazbami delokalizovanými mezi lithiem a koncovým uhlíkem butylových řetězců . V případě n- BuLi jsou klastry tetramery (v diethyletheru ) nebo hexamery (v hexanu ). Tetramerní shluky mají zkreslený kubanu struktury s atomy lithia a methylenchloridu CH 2 skupinystřídavě uspořádané na vrcholcích. Ekvivalentní popis je vidět tetramer jako Li 4 čtyřstěnu pronikající jiným [CH 2 ] 4 čtyřstěnu . Vazby uvnitř klastru jsou stejného typu jako vazby popsané pro diboran ( vazby se třemi středy a dvěma elektrony ), ale jsou složitější, protože zahrnují osm atomů. Vzhledem k jeho elektronově deficitnímu charakteru je n- butyllithium velmi reaktivní vůči Lewisovým bázím .
Vzhledem k velkému rozdílu v elektronegativitě mezi uhlíkem (2,55) a lithiem (0,98) je vazba Li - C silně polarizovaná . Oddělení poplatků se odhaduje mezi 55 a 95% . Takže i když z praktických důvodů je n- BuLi často považován za činidlo, které působí prostřednictvím butylového aniontu , n- Bu - , s kationem Li + , tento model je nesprávný, n- BuLi není iontový.
Příprava
Standardní přípravou pro n- BuLi je reakce 1-brombutanu nebo 1-chlorbutanu s kovovým lithiem :
2 Li + C 4 H 9 X→ C 4 H 9 Li+ Li X , kde X = Cl , Br .Lithium pro tuto reakci obvykle obsahuje 1 až 3% sodíku . Mezi rozpouštědla, používaná pro tuto přípravu zahrnují benzen , v cyklohexanu a diethyletheru . Pokud je prekurzorem 1-brombutan , je produktem homogenní roztok sestávající ze shluků mísících lithiumbromid LiBr a n- butyllithium . Protože n- BuLi tvoří méně stabilní komplex s chloridem lithným LiCl, reakcí s 1-chlorbutanem se získá bílá sraženina LiCl.
Reakce
N -butyllithium je silná báze ( pKa ≈ 50), ale také nukleofilní silný a ozubené kolo , charakter v závislosti na ostatních reakčních činidel. Kromě toho, že je silný nukleofil, n- BuLi se váže na aprotické Lewisovy báze, jako jsou ethery a terciární aminy , které disociují shluky vazbou přímo na centra Li. Tomuto použití jako Lewisovy kyseliny se říká metalizace . Reakce se typicky provádějí v THF nebo diethyletheru , což jsou dobrá rozpouštědla pro organolithné deriváty, které jsou výsledkem BuLi reakce (viz níže).
Metalizace
Jednou z nejužitečnějších chemických vlastností n- BuLi je jeho schopnost protonovat širokou škálu slabých Bronstedových kyselin; terc -butyllithium a sec -butyllithium , jsou v tomto ohledu více základní. N -BuLi lze deprotonaci (v tomto smyslu, metalace ) mnoha typů vazeb C - H , a to zejména, když je základna konjugát stabilizovaných delocalization elektronu nebo jedním nebo více heteroatomy. Příklady zahrnují alkiny ( H - C- R ), methyl sulfidy (H - CH 2 S R) , thioacetaly (H - CH (SR) 2), Jako je například dithianu , methyl fosfiny (H - CH 2 P R 2) , furany , thiofeny a feroceny , (Fe (H - C 5 H 4 ) (C 5 H 5)) . Kromě těchto sloučenin může také deprotonovat kyselější sloučeniny, jako jsou alkoholy , aminy , enolizovatelné karbonylové sloučeniny a jakékoli kyselé sloučeniny, za vzniku alkoholátů , amidů , enolátů a dalších organických derivátů lithia. Stabilita a těkavost z butanu vyplývající z těchto deprotonací reakcí je praktické a pohodlné, ale může být také problém v reakci ve velkém měřítku, protože produkuje velké množství snadno hořlavého plynu :
LiC 4 H 9+ RH → R-Li + C 4 H 10.Kinetická bazicita z n -BuLi je ovlivněna reakčního rozpouštědla nebo korozpouštědla. Rozpouštědla, která tvoří komplex Li + , jako je tetrahydrofuran (THF), tetramethylethylendiamin (TMEDA), hexamethylfosforamid (HMPA) a 1,4-diazabicyklo [2.2.2] oktan (DABCO), dále polarizují vazbu Li - C a urychlují metalaci . Takové ligandy mohou také pomoci izolovat lithiované produkty, typickým příkladem je dilithioferrocen:
Fe (C 5 H 5 ) 2+ 2 LiC 4 H 9+ 2 TMEDA → 2 C 4 H 10+ Fe (C 5 H 4 Li) 2 (TMEDA) 2.Základní Schlosser je superzásady vyrábí zpracováním n -butyllithia se terc -butoxid draselný KOC (CH 3 ) 3. Je kineticky reaktivnější než n- BuLi a často se používá k dosažení obtížné metalizace. Butanolátový anion komplexuje lithium a účinně produkuje butyl draslík , který je reaktivnější než odpovídající lithiovaná sloučenina.
Další příklad použití n -butyllithia jako báze je přidání z aminu na methyl- uhličitanem za vzniku karbamátu , kde n -BuLi slouží k deprotonaci amin:
n -BuLi + R 2 NH+ (MeO) 2 CO→ R 2 N-CO 2 Me+ LiOMe + BuH .Výměna lithium-halogen
N -butyllithium reagovat s některými bromidy a jodidy v reakcích, které tvoří odpovídající organolithné derivátu. Tato reakce je normálně nefunkční s organickými chloridy a fluoridy .
C 4 H 9 Li+ RX → C 4 H 9 X+ RLi (X = Br , I )Tato reakce je vhodnou metodou pro přípravu mnoha typů sloučenin RLi , zejména aryllithiových činidel a některých vinyllithií . Užitečnost tohoto způsobu je však omezeno tím, že se k reakční směsi z 1-brombutanu nebo 1-jodbutan , které mohou reagovat s organolithným derivátu vytvořeného nebo dehydrohalogenací reakcemi , kde n -BuLi slouží jako základ:
C 4 H 9 Br+ RLi → C 4 H 9 R + LiBr. C 4 H 9 Li+ R'CH = CHBr → C 4 H 10 + R'C≡CLi + LiBr.Tyto vedlejší reakce jsou u RI znatelně méně důležité než u RBr, protože rychlost výměny Li-I je o několik řádů rychlejší než rychlost výměny Li-Br. Z tohoto důvodu je výhodné použít primární aryl, vinyl a alkyljodidy a použít spíše t- BuLi než n- BuLi , protože vytvořený t- jodbutan je okamžitě zničen t- BuLi v reakci dehydrohalogenace, která vyžaduje dva ekvivalenty t- BuLi . Alternativně lze vinyllithné sloučeniny připravit přímou výměnnou reakcí mezi halovinylovým a kovovým lithiem nebo výměnou lithium- cín (viz následující část).
Transmetalizace
Rodina souvisejících reakcí je transmetalace, při které si dvě organokovové sloučeniny vyměňují své kovy . Mnoho příkladů takových reakcí zahrnuje výměnu Li-Sn ( lithium - cín ):
C 4 H 9 Li+ Já 3 Sn Ar→ C 4 H 9 Sn Me 3+ Li Ar , kde Ar je skupina aryl a Me skupina methyl .Výměnné reakce lithium-cín mají hlavní výhodu oproti výměnám lithium-halogen pro přípravu derivátů organolithia, protože se vyrobí sloučenina cínu (C 4 H 9 Sn Me 3ve výše uvedeném příkladu), je mnohem méně reaktivní vůči n -BuLi , než jsou halogenované produkty odpovídající výměnu Li-halogen reakce (C 4 H 9 Brnebo C 4 H 9 I). Dalšími kovy a metaloidy, jejichž organické sloučeniny se mohou účastnit těchto výměnných reakcí, jsou rtuť , selen a tellur .
Syntéza karbonylových sloučenin
Organolity , včetně n- BuLi, se používají při syntéze specifických aldehydů a ketonů . Jednou z těchto syntetických cest je reakce organolithia s bisubstituovaným amidem :
R 1 Li + R 2 CON Me 2→ LiN Me 2+ R 2 C (O) R 1 .Carbolithiation
Butyllithium lze přidat do určitých aktivovaných alkenů, jako je styren nebo butadien, a dokonce do ethylenu za vzniku nových organolitů. Tato reakce je základem důležitého komerčního využití n- BuLi pro výrobu polystyrenu (PS) a polybutadienu :
C 4 H 9 Li+ CH 2 = CH - C 6 H 5→ C 4 H 9 –CH 2 – CH (Li) –C 6 H 5.Degradace THF
Tetrahydrofuran (THF) se deprotonuje pomocí n -butyllithia , a to zejména v přítomnosti tetramethylethylendiaminu (TMEDA), se ztrátou jedné ze čtyř atomů vodíku vázaných k atomu uhlíku, který sousedí s atomem z kyslíku . Tento proces, který spotřebovává n -BuLi v generování butan , vyvolané cykloadiční naproti získání enolátu z acetaldehydu a ethylenu . Reakce s n- BuLi v THF se však provádějí při nízké teplotě, obvykle při -78 ° C , což je teplota vhodně udržovaná v lázni pevného oxidu uhličitého v acetonu . Lze použít i nižší teploty ( −25 ° C nebo dokonce −15 ° C ).
Tepelný rozklad
Při zahřátí, n -butyllithium, podobně jako jiné alkyllithia s atomy vodíku v pozici B - tj. Atomy vodíku v p uhlíku sousedící s alfa uhlík , který je vázán k Li - kdy p -hydroelimination který produkuje 1-buten CH 3 CH 2 CH = CH 2a hydrid lithný LiH:
C 4 H 9 Li→ CH 3 CH 2 CH = CH 2+ LiH .bezpečnostní
Je důležité skladovat a manipulovat s jakýmkoli alkyllithiem v inertní atmosféře, aby se zabránilo jakékoli reakci, zejména z bezpečnostních důvodů. K n -BuLi Prudce reaguje s vodou za vzniku hydroxidu lithného (žíravé):
C 4 H 9 Li+ H 2 O→ C 4 H 10+ LiOH .K n -BuLi reaguje s kyslíkem O 2, stejně jako s oxidem uhličitým CO 2tvoří lithium-pentanoát C 4 H 9 COOLi :
C 4 H 9 Li+ CO 2→ C 4 H 9 COOLi.Butyllithium - a konkrétněji terc- butyllithium - je extrémně reaktivní s ohledem na vzduch a vlhkost. Jeho hydrolýza je dostatečně exotermická, aby zapálila rozpouštědlo, které jej rozpouští (komerční zdroje obvykle používají THF, diethylether nebo hexany), takže vystavení atmosféře je dostatečné k tomu, aby vedlo k vznícení . Za určitých okolností, například u jehel, se může sám utěsnit a vytvořit bariéru oxidu a hydroxidu, která zabrání dalšímu přístupu vzduchu. Se všemi izomery a formami butyllithia, které jsou klasifikovány jako „R17“ ( na vzduchu spontánně hořlavé ), se s BuLi vždy zachází v dokonale bezvodé atmosféře dinitrogenu nebo argonu ( neutrální plyny ).
Hlavně kvůli BuLi:
- R11: vysoce hořlavý.
- R14 / 15: prudce reaguje při kontaktu s vodou a uvolňuje extrémně hořlavé plyny.
- R17: spontánně hořlavý na vzduchu.
- R34: způsobuje popáleniny.
Hlavně kvůli rozpouštědlu:
- R48 / 20: zdraví škodlivý: nebezpečí vážného poškození zdraví při dlouhodobé expozici vdechováním.
- R51 / 53: toxický pro vodní organismy, může vyvolat dlouhodobé nepříznivé účinky ve vodním prostředí.
- R62: možné riziko poškození plodnosti.
- R65: zdraví škodlivý: při požití může způsobit poškození plic.
- R67: Vdechování par může způsobit ospalost a závratě.
Reference
- vypočtená molekulová hmotnost od „ atomové hmotnosti prvků 2007 “ na www.chem.qmul.ac.uk .
- Záznam „Butyllithium“ v chemické databázi GESTIS IFA (německý orgán odpovědný za bezpečnost a ochranu zdraví při práci) ( německy , anglicky ), zpřístupněno 8. května 2013 (je vyžadován JavaScript)
- „ Normální butyllithium “ v databázi chemických látek Reptox z CSST (quebecká organizace odpovědná za bezpečnost a ochranu zdraví při práci), zpřístupněno 24. dubna 2009
- Sigma-Aldrichův list sloučeninyRoztok n- butyllithia 11,0 M v hexanech , přístup k 8. květnu 2013.
- Jacques Drouin , Úvod do organické chemie: Organické molekuly ve vašem prostředí. Použití, toxicita, syntéza a reaktivita , sv. 2005, Corbas, Librairie du Cèdre,2005, 1 st ed. , 785 s. ( ISBN 978-2-916346-00-7 a 2-916346-00-7 ) , str. 502
- Brandsma, L.; Verkraijsse, HD; Preparativní polární organokovová chemie I , Springer-Verlag, Berlín, 1987. ( ISBN 3-540-16916-4 )
- Elschenbroich, C .; Organometallics , Wiley-VCH, Weinheim, 2006. ( ISBN 3-527-29390-6 )
- Sanders, R.; Mueller-Westerhoff, UT; Litiace ferrocenu a ruthenocenu - zatažení a zlepšení , J. Organomet. Chem. , 1996, sv. 512, s. 219–224. DOI : 10.1016 / 0022-328X (95) 05914-B
- Ovaska, TV; Encyclopedia of Reagents for Organic Synthesis , n-butyllithium , John Wiley & Sons . 2006. DOI : 10.1002 / 047084289X.rb395
- Greenwood, NN; Earnshaw, A .; Chemie prvků , 2 th ed. 1997, Butterworth-Heinemann, Boston.
- *
- ( fr ) Tento článek je částečně nebo zcela převzat z anglického článku Wikipedie s názvem „ n-Butyllithium “ ( viz seznam autorů ) .