Dioxygen
| Dioxygen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reprezentace dioxygen. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Název IUPAC | dioxygen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyma |
molekulární kyslík |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne o ECHA | 100.029.051 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne o EC | 231-956-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC kód | V03 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O E | E948 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ÚSMĚVY |
O = O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / O2 / c1-2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | bezbarvý plyn při teplotě a tlaku okolí; zkapalněný plyn : bezbarvá až modrá kapalina | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemické vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzorec |
O 2 [izomery] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární hmotnost | 31,9988 ± 0,0006 g / mol O 100%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekulární průměr | 0,292 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzikální vlastnosti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T. fúze | -219 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° vroucí | -183 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rozpustnost | ve vodě při 20 ° C : 3,1 ml / 100 ml, 14,6 mg l -1 (vody při 0 ° C ), |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Objemová hmotnost |
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
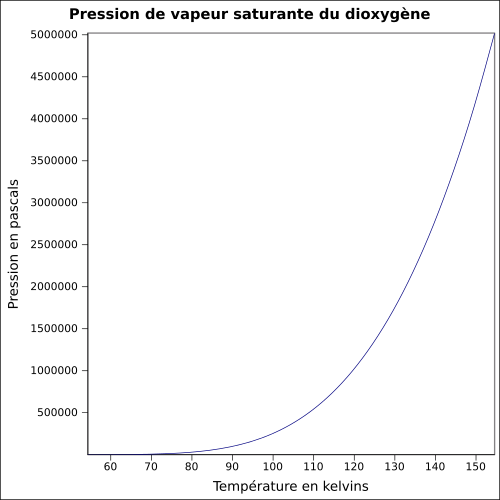
| Tlak nasycených par | při -118 ° C : 5 080 kPa
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritický bod |
−118,67 ° C 50,422 bar 0,636 1 kg l −1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trojitý bod |
−218,7916 ° C 0,00149 bar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 330 m s -1 ( 27 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termochemie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ fus H ° | 213 kJ / kg | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vap H ° | 6,82 kJ mol −1 ( 1 atm , −182,95 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C str |
rovnice:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opatření | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Nebezpečí H270, H270 : Může způsobit nebo zesílit požár; okysličovadlo |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  A, C, : Stlačený plyn kritická teplota = -118,57 ° C C : Oxidační materiál příčiny nebo podporuje spalování z jiného materiálu Disclosure 1,0% podle klasifikačních kritérií |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0 3 0 VŮL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Doprava | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
25 : oxidující plyn (podporuje požár) UN číslo : 1072 : STLAČENÝ KYSLÍK Třída: 2 Štítky: 2.2 : nehořlavé, netoxické plyny (odpovídá skupinám označeným A nebo velkým O); 5.1 : Oxidující látky  
225 : chlazený zkapalněný plyn, okysličovadlo (podporuje požár) UN číslo : 1073 : CHLADICÍ KAPALNÝ KYSLÍK Třída: 2 Štítky: 2.2 : nehořlavé, netoxické plyny (odpovídá skupinám označeným velkým A nebo O); 5.1 : Oxidující látky   |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jednotky SI a STP, pokud není uvedeno jinak. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dioxygen , běžně nazývá kyslík je látka sestávající z molekul O 2 (z nichž každá sestává ze dvou atomů v kyslíku ). Plyn za standardních podmínek pro teplotu a tlak , bezbarvý, bez zápachu a bez chuti, účastní se oxidačně-redukčních reakcí , zejména hoření , koroze a dýchání . Dioxygen je jednou z alotropních forem kyslíku .
Označení „ kyslík “ bez další přesnosti je nejednoznačné, protože tento výraz může označovat prvek kyslík (O) nebo plynný kyslík (O 2). Přestože ozón O 3 je také molekulární sloučenina prvku kyslíku, to je obecně dioxygen na kterou se odkazuje, když se používají pojmy „molekulární kyslík“ a „molekula kyslík“.
Nezávisle objevil v roce 1772 Švéd Carl Wilhelm Scheele v Uppsale a v roce 1774 Britem Josephem Priestleym ve Wiltshire byl kyslík pojmenován v roce 1777 Francouzem Antoine Lavoisierem a jeho manželkou v Paříži ze starořeckého ὀξύς / oxús („akutní“, tj. zde říci „kyselina“) a γενής / genεs („generátor“), protože Lavoisier se mylně domníval - že oxidace a okyselování souvisí - že:
„Dali jsme základnu prodyšné části vzduchu název kyslíku, pocházející to ze dvou řeckých slov ὀξύς , kyselina a γείνομαι , já vytvářet , protože skutečně jedním z nejvíce obecných vlastností tohoto základu [Lavoisier mluví kyslíku] je za vzniku kyselin kombinací s většinou látek. Budeme tedy nazývat plynný kyslík spojení této báze s kalorickými. "
Dioxygen tvoří 20,95% objemových zemské atmosféry (23,2% hmotnostních) a je nezbytným plynem pro většinu současných forem života, kterému dodává oxidační činidlo nezbytné pro fungování buněk ( buněčné dýchání ). Ve vodním prostředí je rozpuštěný kyslík rovněž nezbytný pro život mnoha druhů. Bez kyslíku se obejde pouze archaea a menšinová část bakterií (nazývaných anaeroby ). Produkují anaerobní bakterie kyslíku, které oxidovaly primitivní atmosféru zpočátku snižující a poté obohacené kyslíkem: je ve vzduchu přítomný v hojném množství od Velké oxidace , existuje asi 2,4 miliardy let.
Vznik a vývoj kyslíku v zemské atmosféře
Bylo předloženo mnoho hypotéz, které vysvětlují přítomnost kyslíku v atmosféře:
- nejčastěji se přijímá, že se jedná o plyn produkovaný během fungování sinic a obecněji chlorofylových rostlin , který extrahuje uhlík z oxidu uhličitého (ve formě organických sloučenin) a odmítá kyslík (ve formě dioxygenu) mechanismem fotosyntéza ;
- druhý vyvolá rozkladu, v horní atmosféře , z molekul vody do dioxygen a vodíkem , pod vlivem slunečního a kosmického záření. Jak dihydrogen nakonec unikne do vesmíru (v současné době rychlostí kolem 3 kg / s ), kyslík se hromadí v atmosféře.
Realita dvou existujících jevů může být kombinací těchto dvou procesů.
Sinice
Před 4 miliardami let byla Země téměř úplně pokryta oceány a její atmosféru tvořil metan, amoniak a oxid uhličitý. První bakterie nalezené v oceánu využívají výhradně fermentaci jako zdroj energie. Postupným vývojem získávají schopnost využívat sluneční světlo jako zdroj energie , CO 2.jako zdroj uhlíku a H 2 Onebo H 2 Sjako zdroj vodíku. Je to vzhled fotosyntézy . Tyto organizace autotrofní , to jest, které jsou schopné vytvářet své vlastní živiny, bude rozvíjet, šířit a mutovat do sinic jsou 3,2 miliardy let.
Tyto sinice využívají vodu jako zdroj vodíku a uvolňují do svého prostředí dioxygen, smrtelný jed pro všechny ostatní anaerobní bakterie . Tato soutěž o kyslík mezi bakteriemi je rozhodujícím bodem obratu ve vývoji života. Šíření sinic zcela modifikuje složení atmosféry a oceánů jejich obohacením kyslíkem. Souběžně se vyvíjejí bakterie, aby mohly tento dioxygen použít ve svém metabolismu místo fermentace , jsou to první organismy, které provádějí buněčné dýchání . Ve skutečnosti jsou energetické výnosy dýchání mnohem vyšší než fermentace, což těmto živým bytostem dává nejdůležitější evoluční výhodu.
Asi před 2 miliardami let spolkla primitivní eukaryotická (anaerobní) buňka bakterii schopnou dýchat. Tato bakterie internalizovaná fagocytózou se stane mitochondrií , které jsou v současné době přítomny ve všech aerobních buňkách. Lze také poznamenat, že mitochondrie mají svou vlastní DNA , která má všechny vlastnosti bakteriální DNA ( kruhová DNA ).
Vývoj hladiny kyslíku v zemské atmosféře
Dioxygen v zemské atmosféře téměř neexistoval, než se vyvinula archea a bakterie , pravděpodobně před asi 3,5 miliardami let. Volný stav dioxygen se poprvé objevil ve významném množství během paleoproterozoika (přibližně před 2,5 až 1,6 miliardami let). Během první miliardy let se veškerý kyslík produkovaný těmito organismy spojí s rozpuštěným železem v oceánech a vytvoří pásové železné formace . Když jsou tyto kyslíkové záchytky nasycené, volný kyslík se začne uvolňovat z oceánů před 2,7 miliardami let. Jeho koncentrace dosáhla 10% své současné úrovně před asi 1,7 miliardami let.
Přítomnost velkého množství rozpuštěného kyslíku v oceánech a v atmosféře mohla vést k vyhynutí anaerobních organismů, které pak žijí, během ekologické krize zvané Velká oxidace asi před 2,4 miliardami let. Buněčné dýchání pomocí kyslíku však umožňuje aerobním organismům produkovat mnohem více ATP než anaerobní organismy, což jim pomáhá ovládnout biosféru Země .
Od začátku kambriu před 540 miliony let se vyvinula koncentrace kyslíku v atmosféře, která v průběhu času představovala mezi 15% a 30% jejího objemu. Ke konci karbonu asi před 300 miliony let dosáhla hladina kyslíku v atmosféře maxima: představovala pak 35% objemu atmosféry, což mohlo přispět k velké velikosti hmyzu a obojživelníků té doby. Tento vrchol svého podílu v zemské atmosféře v této době je vzhledem k masivní expanzi na obřích kapradiny lesích na Pangea a k postupnému pohřbu ekologických produktů, které se staly v uhelných ložisek . Lidské činnosti, včetně každoročního spalování 7 miliard tun fosilních paliv , mají velmi malý dopad na množství volného kyslíku v atmosféře. Při současné rychlosti fotosyntézy by výroba veškerého kyslíku přítomného v dnešní atmosféře trvala asi 2 000 let.
Biologické role
Fotosyntéza
V přírodě, volný kyslík je produkován fotolýzou z vody prostřednictvím fotosyntézy . Podle některých odhadů zelené řasy a sinice nalezené v mořském prostředí poskytují asi 70% volného kyslíku produkovaného na Zemi, zbytek produkují suchozemské rostliny . Jiné odhady tvrdí, že podíl oceánů na dodávce kyslíku v atmosféře je větší, zatímco jiné tvrdí opak, což naznačuje, že oceány produkují přibližně 45% atmosférického kyslíku každý rok.
Je napsán globální a zjednodušený vzorec překládající fotosyntézu:6 CO 2+ 6 H 2 O+ fotony → C 6 H 12 O 6+ 6 O 2
nebo jednoduše: oxid uhličitý + voda + sluneční světlo → glukóza + kyslík.
Fotolytická evoluce dioxygenu nastává v thylakoidu fotosyntetických organismů a vyžaduje energii čtyř fotonů . Mnoho kroků je složitých, ale výsledkem je tvorba elektrochemického gradientu napříč thilakoidem, který se používá k syntéze adenosintrifosfátu (ATP) prostřednictvím procesu fotofosforylace . Dioxygen zbývající po oxidaci molekuly vody se uvolní do atmosféry.
Dýchání
Dioxygen je nezbytný v buněčném dýchání u všech aerobních organismů . Tyto mitochondrie použít pro pomoc při výrobě ATP v procesu oxidativní fosforylace . Reakční modelování aerobního dýchání je obecně opakem modelování fotosyntézy a je psáno zjednodušeným způsobem a v případě výnosu oxidace glukózy s výtěžkem 100%:C 6 H 12 O 6+ 6 O 2→ 6 CO 2+ 6 H 2 O+ 2880 kJ mol -1 .Ve skutečnosti se energie používá při tvorbě ATP (molekula, která umožňuje ukládání energie v buňce) z ADP, stejně jako k umožnění transportu molekul nezbytných pro tuto reakci v buňce. Energie skutečně uložená ve formě ATP, a tedy využitelná tělem, je tedy pro jeden mol spotřebované glukózy spíše 1162,8 kJ, to znamená:C 6 H 12 O 6+ 6 O 2→ 6 CO 2+ 6 H 2 O+ 1162,8 kJ mol −1 .U obratlovců kyslík difunduje buněčnými membránami do plic a červených krvinek . Hemoglobin váže kyslík a způsobí změnu barvy proteinu procházející od namodralé červené na jasně červenou. Ostatní zvířata nepoužívají hemoglobin pro transport kyslíku: měkkýši a někteří členovci používat hemocyanin zatímco pavouci a humry používat hemerythrin . Jeden litr krve může rozpustit 200 cm 3 kyslíku.
Tyto reaktivní deriváty kyslíku, jako je například iont superoxidu O 2- a peroxid vodíku H 2 O 2, jsou toxické vedlejší produkty kyslíku používané organismy. Části imunitního systému pokročilých organismů však produkují peroxid, superoxid a singletový kyslík, aby zabíjely napadající mikroorganismy . Reaktivní dioxygenové deriváty také hrají důležitou roli v hypersenzitivní reakci rostlin proti patogenním útokům.
Odpočívající dospělý vdechuje mezi 1,8 a 2,4 gramy kyslíku za minutu. To odpovídá více než šesti miliardám tun kyslíku vdechovaných lidstvem každý rok.
Aerobní respirace je absorbovat kyslík potřebný pro katabolismus oxidační a přínosu energie do buněk. Organismy mají omezující absorpční kapacitu , která se nazývá maximální absorpce kyslíku .
Spotřeba kyslíku je indexem buněčné aktivity. Tato poznámka je počátkem charakterizace biologicky odbouratelného znečištění vzorku vody, biologické spotřeby kyslíku .
Přítomnost v těle obratlovců
Je to v dýchacím systému, než je parciální tlak kyslíku v těle živého obratlovce nejvyšší. Je nejslabší v tepnách , poté v periferních tkáních a ještě více v žilách . Parciální tlak dioxygen je tlak, který by měl dioxygen, pokud by sám zaujímal uvažovaný objem.
| Jednotka | Tlak plynu v plicních alveolách |
Arteriální krevní plyn | Krevní plyn v žilách |
|---|---|---|---|
| kPa | 14.2 | 11–13 | 4.0–5.3 |
| mmHg | 107 | 75–100 | 30-40 |
Struktura
Geometrická struktura
Molekula je diatomická a průměrná vzdálenost mezi dvěma atomy je v základním stavu 120,74 µm .
V prvních dvou excitovaných stavech (viz část spektroskopie níže) se tato vzdálenost zvyšuje na 121,55 μm v prvním stavu a na 122,77 μm ve druhém.
Zastoupení Lewise
Aktuální Lewisova reprezentace kyslíku, takže jeho dva atomy se řídí bytovým pravidlem , je dvojná vazba , přičemž každý atom navíc nese dva nesdílené elektronové dublety . Tato struktura však nezohledňuje paramagnetismus této molekuly. Je možné navrhnout Lewisovo schéma, které respektuje toto experimentální pozorování s jednoduchou vazbou (a nikoli dvojnou vazbou) a jediným elektronem na atom kyslíku.
Netradiční znázornění s jednoduchou vazbou má tu nevýhodu, že nepočítá s krátkou vzdáleností vazby ( d = 120,74 pm ), mnohem kratší než jednoduchá vazba OO jako v peroxidu vodíku.HOOH, pro kterou je délka vazby 145,7 um . To vysvětluje zejména to, proč se v praxi tato struktura používá pouze pro vzdělávací účely, aby se zdůraznila diradická povaha molekuly. Efektivnější popis je získán u molekulárních orbitalů .
Molekulární okružní diagram
V teoretickém rámci molekulárních orbitalů ( metoda CLOA ) se interakce mezi dvěma atomy kyslíku za vzniku molekuly odráží v opačném diagramu.
Dva 2s orbitaly dvou atomů kyslíku, zpočátku stejné energie, podléhají degeneraci, tvořící vazbu σ 2s orbitální a σ orbitální*
2 s antiliante, oba plně obsazeni, což nemá za následek žádnou vazbu mezi těmito dvěma atomy. Šest 2p orbitaly dvěma atomy také podléhat degeneraci, tvořit tři å 2px , å 2PY a σ 2PZ orbitaly a tři å orbitalů*
2px , σ*
2py a σ* 2
pz antiadheziva. Osm (2 × 4) 2p elektronů je distribuováno následovně:
- šest elektronů zaujímá tři nízkoenergetické vazebné orbitaly;
- každý dva zbývající elektrony zaujímají antiliující orbitál.
Tato kombinace 2p orbitalů proto vede ke třem vazebným molekulárním orbitalům a jednomu antiliantu, tj. Vazebnému indexu 2. Distribuce dvou elektronů na těchto dvou antiliačních orbitálech také vysvětluje diradikální povahu dioxygenu. Tato vlastnost být radikál, zatímco počet elektronů v molekulách je dokonce jedinečný, je mezi diatomickými molekulami jedinečný. Tato distribuce také vysvětluje paramagnetický charakter dioxygenu, který nelze předpovědět z jeho „klasického“ Lewisova zobrazení.
Tento stav stavu tripletů dává molekule magnetické vlastnosti (viz níže) a lze jej činit odpovědným za jeho chemickou inertnost při teplotě místnosti. Ve skutečnosti reakce O 2s jinou molekulou (H 2, organické molekuly), který je téměř vždy ve stavu singletu, aby se vytvořila molekula ve stavu singletu, probíhá bez zachování celkové rotace; to je příčina velké pomalosti chemických reakcí zahrnujících kyslík při běžné teplotě a tlaku.
Spektroskopie
První dvě hladiny excitovaného kyslíku jsou dva singletové stavy při 15 800 cm -1 ( 94,72 kJ mol -1 ) a 21 100 cm -1 ( 157,85 kJ mol -1 ) (viz obrázek). Tyto přechody jsou zakázány rotací, což vede k tomu, že kyslík je bezbarvý. To je případ plynné fáze, kdy modrá barva atmosféry je způsobena Rayleighovým rozptylem .
Modrá barva v kapalném stavu (viz níže), výsledky z absorpce dvou fotonů na 7,918 cm -1 na kombinaci dvou molekul dioxygen ( O 4 dimeru ).
Magnetismus
Dioxygen je paramagnetický . Tuto vlastnost pozoroval Faraday již v roce 1848. Odráží to kyslíkový molekulární orbitální diagram sledovaný metodou CLOA . Elektronická konfigurace skutečně obsahuje dva jednotlivé elektrony na dvou orbitálech Π * ( stav tripletů ).
U nukleární magnetické rezonance (NMR) je pro jemná měření důležité odplynit vzorek, aby se vyloučil molekulární kyslík, který je paramagnetický a bude interferovat s detekcí tím, že způsobí rozšíření vrcholů. Toto odplynění se obecně provádí probubláváním inertního plynu (dusíku nebo argonu) v roztoku, aby se nahradily plyny rozpuštěné tímto inertním a neparamagnetickým plynem.
Výroba
Průmyslová produkce
Dioxygen se průmyslově získává hlavně (95%) kryogenní separací sloučenin ze vzduchu , to znamená zkapalněním vzduchu a následnou frakční destilací .
Tyto kritické teploty z dusíku N 2( T c = -146,9 ° C ) a kyslíku O 2( T c = -118,4 ° C ) neumožňují zkapalnění vzduchu jednoduchým stlačení . Vzduch proto musí být stlačen mezi 5 a 7 bary, poté filtrován, sušen, dekarbonizován adsorpcí na molekulárním sítu a nakonec ochlazen tepelnou výměnou mezi přiváděným plynem a zkapalněnými plyny. Ztráty z chlazení jsou kompenzovány expanzí 5 až 10% proudu upraveného plynu v turbíně, jejíž vnější práce je obnovitelná.
Destilace se v nejpoužívanějším procesu provádí ve dvojité koloně, která umožňuje kontinuálně získávat čisté plyny. První kolona (střední tlak, 5 bar) provádí první separaci vzduchu na čistý plynný dusík (na 99,999%) nahoře a kapalinu bohatou na kyslík (přibližně 40%) na bázi. Tato kapalina je poté odeslána do poloviny druhé destilační kolony (nízký tlak, 1,3 bar). Kyslík O 2na bázi tohoto druhého sloupce se získá mezi 99,5% a 99,7%. Obsahuje méně než 1 ppm dusíku, hlavní nečistotou je argon .
Destilační kolony mají průměr mezi 1 a 6 ma měří 15 až 25 m . Jsou vyrobeny z nerezové oceli nebo hliníku a mají přibližně sto podnosů. Tepelná izolace se provádí perlitem (expandovaný křemičitý písek). Udržování teploty kolon spotřebuje pouze 6 až 7% z celkové vynaložené energie.
Spotřeba energie je 0,4 kWh m −3 plynného kyslíku, tedy 50 až 60% z nákladové ceny.
Asi 5% průmyslového kyslíku se vyrábí jiným, ne-kryogenním procesem, který se nazývá VPSA ( vakuová tlaková adsorpce ) nebo adsorpce střídavým tlakem a vakuem.
Okolní vzduch se vysuší a čistí filtrací, potom prochází přes kolonu zeolitů , které adsorbují dusík N 2 rychleji.než kyslík O 2. Zeolity mohou fixovat 10 litrů dusíku na kilogram. Když jsou nasyceny, vzduch je odeslán do druhé kolony, zatímco dinitrogen z první kolony je desorbován ve vakuu. Čistota takto získaného dioxygenu odstraněním dusíku ze vzduchu může dosáhnout 90 až 95%. Tento dioxygen stále obsahuje 4,5% argonu, který stejně jako dioxygen není adsorbován. Spotřeba energie je 0,4 až 0,5 kWh m −3 kyslíku. Tato metoda se stále více používá v průmyslových procesech, jejichž potřeby jsou nižší než 100 tun denně, i v domácích respirátorech. Viz také Koncentrátor kyslíku .
Vyrobený kyslík je transportován:
- v kapalné nebo plynné formě potrubím zvaným oxidy nebo kyslíkem ;
- v plynné formě stlačené v ocelových lahvích nebo nádržích při 200 barech;
- v kapalné formě, v cisternových vozech .
V roce 1995 vyrobilo osm společností po celém světě téměř veškerý průmyslový kyslík:
- Air Liquide (Francie): 17%;
- BOC (Velká Británie): 14% (získaná Linde v roce 2006);
- Praxair (USA): 14%;
- Air Products (USA): 8%;
- Nippon Sanso (Japonsko): 7%;
- AGA (Švédsko): 7% (získaná Linde v roce 2000);
- Messer (Německo): 6%;
- Linde (Německo): 6%.
Hlavními producentskými zeměmi v roce 1996 byly:
- USA: 27 milionů tun;
- Japonsko: 12,7 milionu tun;
- Francie: 3,23 milionu tun.
Worldwide, celková produkce se pohybovala okolo 100 milionů tun v roce 1996, nebo 1 / 10 miliontiny kyslíku v atmosféře.
V laboratoři
Dioxygen již dlouho připraven v malých množstvích, v laboratoři, reakcí oxylith Na 2 O 2 s vodou.
To může být produkován katalytickou rozkladem z peroxidu vodíku v přítomnosti manganu ( IV ) oxid MnO 2.
Tyto dvě výrobní metody obecně používají sestavu vytěsňování vody ke sběru produkovaného kyslíku.
Může být také připraven elektrolýzou vody pro vzdělávací ukázky, ale tato technika je pomalá a energeticky nákladná.
Reaktivita
Dioxygen je termodynamicky velmi reaktivní a většina jeho reakcí je silně exotermická. Tato velká reaktivita obvykle neprobíhá při pokojové teplotě. Kinetické důvody byly podrobně popsány výše.
S jednoduchými těly
Několik jednoduchých těl se nekombinuje přímo s kyslíkem: wolfram W, platina Pt, zlato Au a vzácné plyny . Je třeba poznamenat, že však existují okysličené sloučeniny vzácných plynů (XeO 3), ale nikdy je nebylo možné získat přímým působením s O 2.
Skutečnost, že oxidy existují téměř pro všechny chemické prvky, do značné míry pomohla Mendělejevovi tyto prvky klasifikovat ( 1869 ). Navíc skutečnost, že určité prvky mají několik odlišných oxidů (například dusík ), byla původem vzniku pojmu atom u Daltona ( 1800 ).
Ionty O 2
Mnoho iontů O 2 jsou známy :
- dioxygenyl ion , O 2+ , ve vzácných sloučeninách;
- iont superoxidu , O 2- , častý anion v biologických systémech, pro které je redox často monoelektronický; je to nestabilní entita;
- peroxidový iont O 22- , anion běžný v peroxidech kovů, jako je peroxid barnatý BaO 2 ; dioxygen má stejný stupeň oxidace jako v peroxidu vodíku H 2 O 2.
Reakce singletového kyslíku 1 O 2
Singlet dioxygen je produkován světelným ozářením triplet dioxygen (jeho základní stav ) 3 O 2fotosenzibilizátorem. K tomu musí být excitovaný stav posledně jmenovaného větší než 94,7 kJ mol −1 (viz část spektroskopie výše ).3 O 2+ 1 senzibilizátor - hν → 1 O 2+ 3 senzibilizátor.
Singlet dioxygen lze také vyrobit chemicky, například v alkoholovém roztoku, se směsí peroxidu vodíku a bělidla :H 2 O 2+ ClO - → Cl - + H 2 O+ 1 O 2.
Singlet dioxygen je velmi reaktivní, chemicky i biologicky.
Použití
Dioxygen ve vzduchu se používá ke spalování (topení, transport).
Odděleno od dusíku se používá hlavně v ocelářském průmyslu . Železo opuštění vysoké pece je ve formě Fe 3 C karbidu, nepoužitelný, protože obsahuje více než 4% hmotnostní uhlíku. Tento uhlík se spaluje vstřikováním kyslíku přímo do roztaveného železa. Toto je princip převaděčů . Je zapotřebí 60 m 3 CNTP kyslíkuna tunu železa. Spotřeba ocelárny se pohybuje v tisících tun O 2 denně.
Petrochemický je také důležitý pro spotřebitele, pokud jde o výrobu ethylenoxidu , z propylenoxidu , z vinylchloridu od oxychloraci , při rafinaci ropných produktů, pro regeneraci katalyzátorů, atd
Jiné procesy také vyžadují velkou tonáž kyslíku:
- syntéza oxidu titaničitého chlorovým procesem ;
- bělení z buničiny , což omezuje spotřebu chloru Cl 2 , která zůstává hlavní bělicí činidlo;
- opětovného zpracování některých chemických odpadů, například síru obsahující odpad z výroby methylmethakrylátu , což vede k oživení H 2 SO 4.
Jiná příležitostná použití jsou například:
- produkce plamenů při vysoké teplotě, jako je výroba kyslíko - vodíkového hořáku ;
- jako medicinální plyn :
- Normobarická kyslíková terapie (při atmosférickém tlaku): při respirační pomoci lidem s dýchacími obtížemi (nemoci jako astma nebo chronické respirační selhání nebo během anestézie ), k umělé ventilaci ( zastavení dýchání ),
- hyperbarická kyslíková terapie (vysoký tlak): k léčbě určitých otrav plyny (zejména oxidu uhelnatého ), dekompresních nehod při potápění nebo určitých popálenin, určitých arteritických patologií.
-
Schéma převaděče s přívodem kyslíku přímo do roztaveného kovu.
-
Převaděč v provozu; reakce roztaveného železa s kyslíkem produkuje sprchy světla.
-
Balený lékařský kyslík.
Rozličný
Dioxygen je součástí seznamu základních léků Světové zdravotnické organizace (seznam aktualizován vduben 2013).
Poznámky a odkazy
Poznámky
- Stejné dvojznačnost týká mnoho dalších prvků ( vodík , dusík , chlor , atd ).
- Oxid uhličitý se uvolňuje z jiné části hemoglobinu prostřednictvím Bohrova jevu .
- (1,8 gramů / minutu na osobu) × (60 minut / hodinu) × (24 hodin denně) × (365 dní / rok ) × (6,6 miliardy lidí) ÷ (1 000 000 gramů na tunu) = 6,24 miliardy tun.
Reference
- OXYGENE et OXYGENE (LIQUEFIED) , bezpečnostní listy Mezinárodního programu pro bezpečnost chemických látek , konzultovány 9. května 2009.
- vypočtená molekulová hmotnost od „ atomové hmotnosti prvků 2007 “ na www.chem.qmul.ac.uk .
- Zápis čísla CAS „7782-44-7“ do chemické databáze GESTIS IFA (německý orgán odpovědný za bezpečnost a ochranu zdraví při práci) ( německy , anglicky ), přístup 28. ledna 2009 (je vyžadován JavaScript) .
- (en) Robert H. Perry a Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 s. ( ISBN 0-07-049841-5 ) , str. 2-50.
- Zápis z Mezinárodní výbor pro míry a váhy , 78 th zasedání, 1989, str. T1-T21 (a str. T23-T42, anglická verze).
- (in) WM Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 th ed. , 2610 s. ( ISBN 978-1-4398-2077-3 ) , s. 14-40.
- (in) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press,2009, 90 th ed. , 2804 s. , Vázaná kniha ( ISBN 978-1-4200-9084-0 ).
- Indexové číslo v tabulce 3.1 přílohy VI nařízení ES n o 1272/2008 (16. prosince 2008).
- „ Kyslík “ v databázi chemických produktů Reptox z CSST (quebecká organizace odpovědná za bezpečnost a ochranu zdraví při práci), zpřístupněno 25. dubna 2009.
- Lavoisier A. (1789). Elementary Treatise on Chemistry , 1864, str. 48 .
- (in) University of Wisconsin. (2006), Rozpuštěný kyslík: závisí na tom vodní život , Water Action Volunteers-Volunteer Stream Monitoring Factsheet Series , číst online (přístup k 25. únoru 2010).
- „ Jaká byla atmosféra Země před 4 miliardami let?“ - notre-planete.info ” , na our-planete.info (konzultováno 15. února 2018 ) .
- (in) Heinrich D. Holland, „Okysličení atmosféry a oceánů“ , Phil. Trans. R. Soc. B , 361, 903–915, 19. května 2006, DOI : 10.1098 / rstb.2006.1838 .
- Archean .
- Brzy prvohor .
- Hlavní část prvohor .
- Pozdní proterozoikum .
- Phanerozoic .
- (in) Neil A. Campbell a Jane B. Reece , Biology , San Francisco, Pearson-Benjamin Cummings2005, 7 th ed. , 1231 str. ( ISBN 0-8053-7171-0 ) , str. 522-23.
- (in) Scott Freeman , Biological Science, 2nd , Upper Saddle River, NJ, Pearson-Prentice Hall,2005( ISBN 0-13-140941-7 ) , str. 214, 586.
- (en) Robert A. Berner , „ Atmosférický kyslík ve fanerozoickém čase “ , Sborník Národní akademie věd USA , sv. 96, n o 20,1999, str. 10955–57 ( PMID 10500106 , DOI 10.1073 / pnas.96.20.10955 , číst online ).
-
DOI : 10.1111 / j.1472-4669.2009.00188.x
Tato nabídka bude vygenerována za několik minut. Ocas můžete přeskočit nebo jej dokončit ručně . - (en) John Emsley , Nature's Building Blocks: An AZ Guide to the Elements , Oxford, England, Oxford University Press ,2001, 538 s. ( ISBN 0-19-850340-7 , číst online ) , s. 297-304.
- (in) Malcolm Dole , „ The Natural History of Oxygen “ , The Journal of General Physiology , sv. 49, n o 1,1965, str. 5-27 ( PMID 5859927 , DOI 10.1085 / jgp.49.1.5 , číst online ).
- (in) William Fenical , „Mořské rostliny: jedinečný a neprozkoumaný zdroj“ v rostlinách: potenciál pro těžbu bílkovin, léků a dalších užitečných chemikálií (semináře) , DIANE Publishing,Září 1983( ISBN 1-4289-2397-7 , číst online ) , s. 147.
- (in) JCG Walker , Cyklus kyslíku v přírodním prostředí a biogeochemické cykly , Springer-Verlag ,1980.
- (in) Theodore L. Brown a Burslen LeMay , Chemistry: The Central Science , Prentice Hall / Pearson Education,2003( ISBN 0-13-048450-4 ) , str. 958.
- (en) Peter H. Raven , Ray F. Evert a Susan E. Eichhorn , Biology of Plants, 7. vydání , New York, WH Freeman and Company Publishers,2005( ISBN 0-7167-1007-2 ) , str. 115-27.
- „ složkách života na Zemi i ve vesmíru “ , European Space Agency (přístupné 28.června 2013 ) , str. 3.
- (in) Albert Stwertka , to the Elements Guide , Oxford University Press ,1998, 240 s. ( ISBN 0-19-508083-1 ) , str. 48-49.
- Charles A. Janeway a Paul Travers ( překlad z angličtiny) Imunobiologie: základní a patologický imunitní systém , Paříž / Brusel, De Boeck,2003, 784 s. ( ISBN 2-7445-0150-6 ) , str. 41.
- (in) „ Omezovač průtoku pro měření respiračních parametrů “ , Patenstorm (přístup k 28. červnu 2013 ) : „ U lidí je normální objem 6-8 litrů za minutu. " .
- (in) Charles Henrickson , Chemistry Cliffs Notes2005, 440 s. ( ISBN 0-7645-7419-1 ).
- Výsledek získaný z hodnoty v mmHg s použitím pro převod 0,133 322 kPa / mmHg .
- (in) „ Tabulka normálních referenčních rozsahů “ , University of Texas Southwestern Medical Center, Dallas (přístup k 28. červnu 2013 ) .
- (in) „ Medical Education Division of the Brookside Associates → ABG (Arterial Blood Gas) “ (přístup k 28. červnu 2013 ) .
- chemie prvků , s. 606.
- (in) NN Greenwood a A. Earnshaw, Chemistry of the Elements , Boston Oxford, Butterworth-Heinemann,1997, 2 nd ed. ( 1 st ed. , 1984), 1341 str. ( ISBN 978-0-7506-3365-9 , OCLC 804401792 ) , s. 615.
- Vigne J.-L., Průmyslová data .
- (in) WHO Model List of Essential Medicines, 18. seznam , duben 2013.
Podívejte se také
Související články
Bibliografie
- Davis JC (1975), Waterborne rozpuštěný kyslík požadavky a kritéria se zvláštním důrazem na kanadské prostředí , v přidruženém výboru pro vědecká kritéria kvality , národní










